Access Agilent 电子期刊 2015 年 4 月
>> 更新资料 | 订阅 Access Agilent | 文章目录

优异的色谱性能在生物分析方法中的重要性
Sreelakshmy Menon 和 Siji Joseph
印度生命科学中心 (LSCI) 应用科学家
Smriti Khera 博士
安捷伦制药部市场经理
生物基质中的药物代谢物分析是一项极具挑战的任务。首先需要将目标分析物从基质干扰中分离出来。 这些干扰物很难去除,并且可能引起质谱中的离子抑制,从而导致灵敏度下降。在这些研究中,通常需要同时对母体药物的消失及代谢物的形成进行监控,从而构成了动态范围的挑战。此外,在少量样品中检测低浓度代谢物时需要高灵敏度(nM 至 fM)的检测限。更重要的是,这些分析必须保持始终如一的准确度和重现性,甚至能够在不同实验室间实现转移。
合理的方法可产生更好的生物分析结果
LC/MS 可提供生物分析方法通常所需的灵敏度及检测动态范围,无疑是最适用于此类分析的仪器。但是,质谱分析之前的良好色谱方法同样对最终的分析结果有着巨大影响。本文通过对血浆样品中两种药物(氨甲喋呤和柳氮磺胺吡啶)的定量,阐述了良好的色谱方法在生物分析中的重要性。该分析中采用了 Agilent 1290 Infinity 二元液相色谱系统及配备安捷伦 60 mm 最大光强高灵敏度流通池的 Agilent 1290 Inifinity 二极管阵列检测器。配合安捷伦 Chemstation OpenLab CDS 软件 C.01.05 版使用。[1]
类风湿性关节炎的联合治疗:氨甲蝶呤 + 柳氮磺胺吡啶
氨甲喋呤 (MTX) 在类风湿性关节炎 (RA) 的治疗中被视为一种“锚定药”,并且是一种最有效的疾病修饰抗风湿药物 (DMARD),毒性更小,耐受性更高。但是,MTX 单独使用不能全面控制疾病活性。实际上,99% 的风湿病学家通常将 MTX 与其他非生物 DMARD 联合使用。其中一种常与 MTX 联用的药物为柳氮磺胺吡啶 (SSZ)。虽然已有多种分析方法用于单独分析 MTX 或 SSZ,但是还未报道过可同时测定 MTX 及 SSZ 的分析方法。
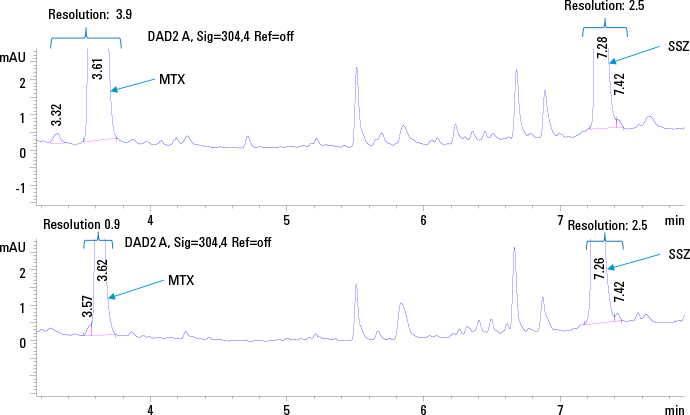
图 1. 采用 SPE(上图迹线)和蛋白质沉淀(下图迹线)在 304 nm 处获得的含有 12.5 ng/µL MTX 及 SSZ 的标准血浆溶液的 HPLC 色谱图
 放大图片
放大图片
图 2. 采用 SPE 在 304 nm 处获得的含有 2 ng/µL MTX (Rt = 3.6 min) 及 SSZ (7.2 min) 的标准血浆溶液的洗脱图谱与空白血浆色谱图的叠加图
 放大图片
放大图片
图 3. 在 LLOQ 下 MTX 色谱图与空白图的叠加图(重复测定两次)
用于定量氨甲喋呤与柳氮磺胺吡啶的简单 HPLC/DAD 方法
我们使用 Agilent 1290 Inifinity 二元液相色谱系统同时测定血浆中的 MTX 与 SSZ。优化的色谱方法可为两种分析物之间,以及分析物与背景基质干扰之间的提供极高的选择性。我们还比较了两种样品前处理策略,分别为离线固相萃取 (SPE) 以及蛋白质沉淀,以确定它们对最终分析结果的影响(图 1)。
通过对血浆校准标样的分析物峰曲线下面积 (AUC) 与浓度为 12.5 ng/µL 标准溶液测得的 AUC 进行比较来评价蛋白质沉淀与 SPE 的提取效率。与预期相同,我们发现利用 Bond Elut-C18 萃取柱(100mg,3 mL)的 SPE 方法可获得更高的提取效率和更好的分离度,因此可在更宽的校准范围内实现更灵敏的检测。针对定量方法,选择 SPE 方法进行样品萃取。
接着,我们优化了色谱方法以实现 MTX 和 SSZ 的最佳选择性,并且使目标分析物与基质峰获得更高的分离度,总分析时间为 15 分钟(图 2)。结果表明,安捷伦 3.0 x 150 mm,2.7µm Poroshell 色谱柱对分析物具有更好的保留性能,且梯度洗脱可实现最佳分离。在梯度开始时采用低浓度的有机相(10% 有机物)可实现分析物与初始极性基质背景的最佳分离。在重新平衡前,梯度分析结束时使高组分有机相(95% 有机物)保持 5 分钟,可使后洗脱的分析物 SSZ 与后洗脱的基质干扰实现良好分离。
关键分析性能标准的方法验证
该方法在动态范围 0.02-100 ng/µL 内 (MTX) 及 0.1-100 ng/µL (SSZ) 内呈线性。MTX 的检测限及最低定量限分别为 0.01 和 0.02 ng/µL,信噪比分别为 6 和 10。而 SSZ 的检测限及最低定量限分别为 0.05 和 0.1 ng/µL,信噪比分别为 8 和 18。图 3 展示了最低定量限下 MTX 色谱图与空白图的典型叠加谱图(重复测定两次)。通过两次重复进样确定最低定量限下的色谱重现性。最低定量限下,MTX 的曲线下面积及保留时间的 %CV 分别为 0.02% 和 1.46%,而 SSZ 则分别为 0.01% 和 0.79%。
结果进一步验证了该方法与 FDA 指南的要求一致,其中采用质量控制样品进行关键分析性能标准验证,包括回收率、重现性、选择性、准确度和精度。表 1 对结果进行了总结。
QC |
目标分析物 (ng/µL) |
MTX (n=5) |
SSZ (n=5) |
||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|
平均回收率 (ng/µL) |
准确度 (%) |
变异系数 (%) |
Rt RSD (%) |
AUC RSD (%) |
平均回收率 (ng/µL) |
准确度 (%) |
变异系数 (%) |
Rt RSD (%) |
AUC RSD (%) |
||
低浓度 QC |
0.8 |
0.70 |
87.7 |
1.02 |
0.03 |
0.26 |
0.82 |
102.2 |
0.86 |
0.09 |
0.34 |
中浓度 QC |
8.0 |
8.1 |
101.1 |
0.26 |
0.03 |
0.25 |
7.5 |
94.2 |
0.28 |
0.02 |
0.41 |
高浓度 QC |
80.0 |
75.5 |
94.3 |
0.29 |
0.03 |
0.29 |
78.1 |
97.6 |
0.29 |
0.02 |
0.29 |
表 1. QC 样品结果汇总,包括回收率、准确度、准确度 %CV,保留时间 (Rt) RSD 以及 AUC RSD
采用安捷伦 HPLC/DAD 解决方案优化生物分析方法
这种首次报道的简单且稳定的 HPLC/DAD 方法可同时定量氨甲喋呤和柳氮磺胺吡啶,具有更高的灵敏度和更宽的校准范围。与之前报道的 MTX UV 方法相比,该方法只需极小体积 (200 µL) 的血浆样品即可获得出色的结果。
此外,该方法表明良好的色谱方法在优化生物分析方法所需的每项关键性能标准中的重要性。虽然不采用质谱检测很难实现这类研究通常所需的 nM 到 fM 级方法灵敏度,但在方法开发中,色谱方法的优化对于实现该目标来说至关重要。
有关该应用的更多详情,请参见 LCGC 杂志的二月刊。然后了解安捷伦制药行业解决方案。
参考文献
- Smriti Khera, Sreelakshmy Menon, Siji Joseph; Simultaneous Determination of Methotrexate and Sulfasalazine in Plasma by HPLC–DAD; LCGC North America Volume 33 Number 2; February 1, 2015
>> 更新资料 | 订阅 Access Agilent | 文章目录