어세이 실행 방법
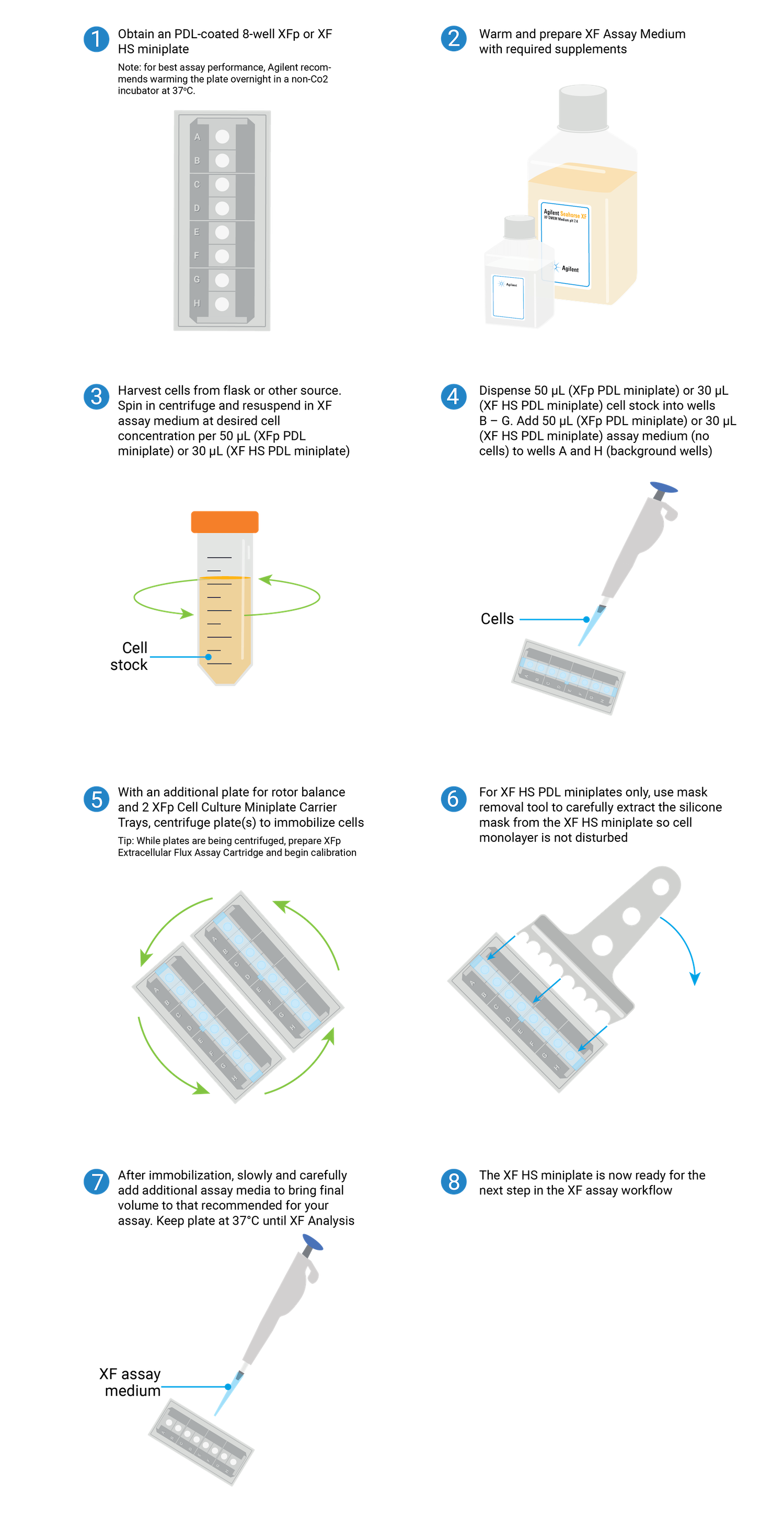
Seahorse XF 어세이 학습 센터


상단
성공적인 어세이를 위한 절차, 기술 및 리소스
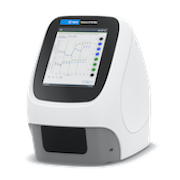
이 학습 센터는 최적의 XF 어세이 성능과 결과를 보장하는 절차와 기술에 중점을 두고 Seahorse XF 분석 워크플로를 소개하도록 설계되었습니다. 이 절차는 Agilent Seahorse XF Real Time ATP 생성율 어세이 세포 에너지 표현형 테스트를 사용하여 초기 세포 특성 규명을 수행하는 방법을 설명합니다. 설명된 기술은 부착 세포 분주, 주입 포트 로딩 등과 같은 모든 Seahorse XF 어세이에 적용됩니다. 필요한 소모품만 XF 분석기 모델 및 XF 어세이 키트에 따라 달라집니다. 드롭다운 메뉴를 사용하여 XF 분석기를 선택한 다음 아래 섹션을 클릭하여 XF 어세이 워크플로의 해당 단계에 대한 관련 콘텐츠가 표시됩니다.
참고: XF HS Mini 분석기는 표준 XFp miniplate, XFp PDL miniplate, XF HS miniplate 및 XF HS PDL miniplate와 호환됩니다. XF HS miniplate 및 XF HS PDL miniplate는 웰당 훨씬 적은 수의 세포로 XF 어세이를 수행하여 비증식성 또는 제한된 양의 세포에 대한 기능 분석을 촉진하기 위해 설계되었습니다.
XFp miniplate와 XF HS miniplate는 모두 8웰 세포 배양 플레이트로 구성되어 있지만 XF HS miniplate는 각 웰 중앙에 돌출된 "링" 요소가 있다는 점에서 다릅니다. 이는 웰당 면적이 0.031cm2임을 의미하며, 이는 표준 XFp 세포 배양 플레이트 면적의 약 30%입니다. XF HS miniplate는 실리콘 세포 분주 마스크와 플레이트 뚜껑이 사전 조립되어 있습니다. XF HS miniplate의 각 패키지에는 마스크 제거 도구가 포함되어 있습니다.
참고: XF HS miniplate와 XFp miniplate 모두 세포 밀도 최적화를 권장합니다.
1. 어세이 재료 수집
이 섹션에는 XF 어세이를 설정하는 데 필요한 재료가 나열되어 있습니다.
이 섹션에는 XF 어세이를 설정하는 데 필요한 재료가 나열되어 있습니다.
참고: 모든 XFp 어세이 키트 및 소모품은 XF HS Mini 분석기와 호환됩니다.
1.1 애질런트의 필수 재료
- 컨트롤러가 포함된 Agilent Seahorse 분석기
- Agilent Seahorse 분석기
- Agilent Seahorse XFe96 FluxPak / XFe96 FluxPak mini
- Agilent Seahorse FluxPak
- Agilent Seahorse FluxPak
- Agilent Seahorse XFp 또는 XFp PDL FluxPak
- Agilent Seahorse XFp, XFp PDL, XF HS 또는 XF HS PDL Mini FluxPak
- 적합한 어세이 키트
- 적합한 XFp 어세이 키트
- 적합한 XF 어세이 배지
- Seahorse XF DMEM 어세이 배지, pH 7.4 또는 Seahorse XF RPMI 어세이 배지, pH 7.4
- Seahorse XF Glucose(1.0M 용액)
- Seahorse XF Pyruvate(100mM 용액)
- Seahorse XF Glutamine (200 mM 용액)
XF HS Mini 어세이를 위한 최적의 miniplate 결정
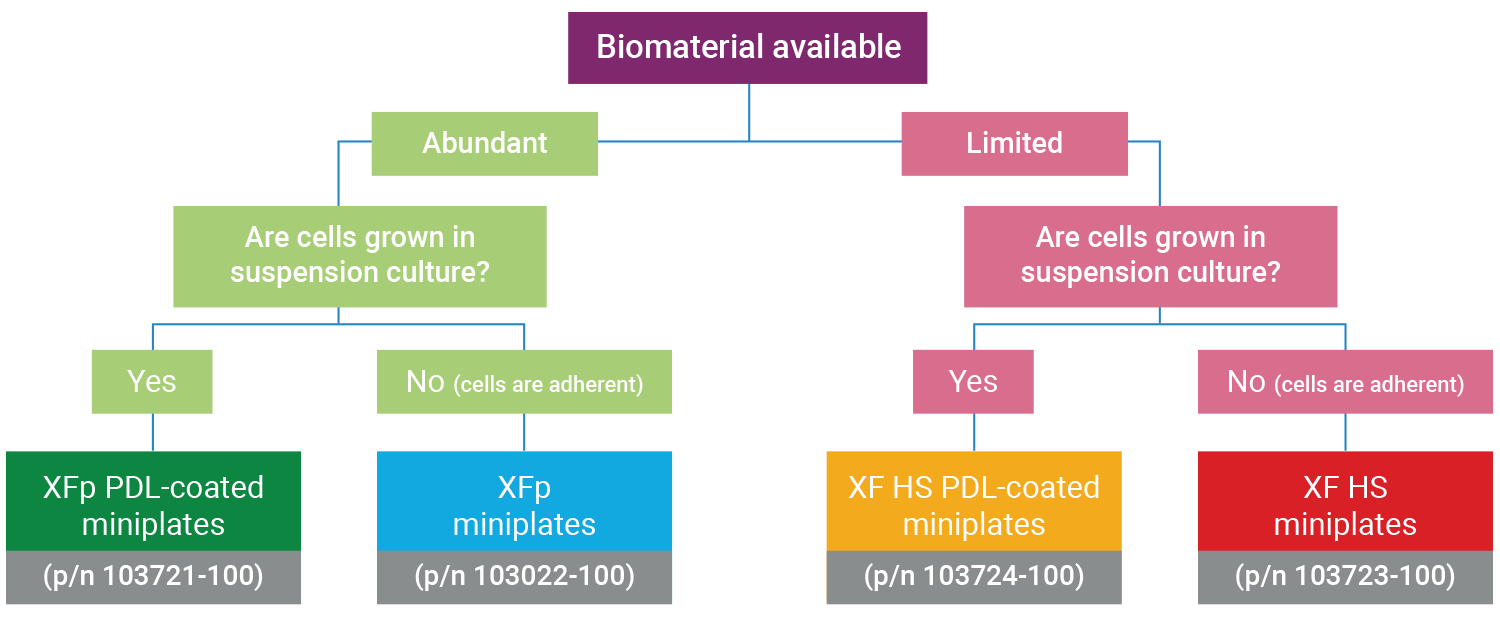
XF HS Mini 분석기는 모든 Seahorse XFp 키트, 시약, 세포 배양 플레이트 및 FluxPak과 호환됩니다.
관련 지원 자료
- 교육 웨비나: 어세이 재료 수집
- Seahorse XF 센서 카트리지 및 조직 배양 마이크로플레이트
- Seahorse XF 어세이 키트 및 시약
- 소모품 가이드
- 소모품 가이드
- 소모품 가이드
- 소모품 가이드
- 소모품 가이드
- 소모품 가이드
- Seahorse XF 배지 및 완충액 선택 가이드
- XF 어세이 배지 준비
- XF 어세이 배지 준비
- 세포 특성 규명: XFe96/XF96 분석기 및 Seahorse XF Real-Time ATP 생성률 어세이
- 세포 특성 규명: XFe24 분석기 및 Seahorse XF Real-Time ATP 생성률 어세이
- 세포 특성 규명: XFp 분석기 및 Seahorse XFp Real-Time ATP 생성률 어세이
- 세포 특성 규명: XF HS Mini 분석기 및 XF Real-Time ATP 생성률 어세이
- 세포 특성 규명: HS miniplate와 XF Real-Time ATP 생성률 어세이를 갖춘 XF HS Mini 분석기
참고 자료
- Agilent Seahorse 어세이 가이드 및 템플릿
- Agilent Seahorse 어세이 가이드 및 템플릿
- Agilent Seahorse 어세이 가이드 및 템플릿
- Agilent Seahorse 어세이 가이드 및 템플릿
- Agilent Seahorse 어세이 가이드 및 템플릿
- Agilent Seahorse 템플릿
- 애질런트 세포 분석 발행물 데이터베이스
Agilent Cell Analysis 데이터를 사용하여 발행물의 전체 목록을 살펴보세요.
1.2 사용자가 제공하는 기타 필수 재료
기타 필수 재료
- 37°C non-CO2 인큐베이터
- 세포 카운터/혈구계수기
- 37 °C 수조
- 증류 또는 멸균 H2O
- 도립형 명시야 현미경
- 터치 볼텍스
- 15 및 50mL 코니칼 튜브
- P200, P1000, 8 및/또는 12채널 P200 피펫
- P200, P1000, 8채널 P200 피펫
- 시약 저장 용기
권장 재료
- 세포 배양 플레이트용 어댑터가 포함된 원심분리기(부유 세포 유형을 사용하는 경우 필요함)
- 마이크로 원심분리기
- 검량된 pH 측정기*
- 교반 플레이트*
- 멸균 필터병(0.22μm 필터) 및 캡*
- 1.0N NaOH 용액*
(* Seahorse XF DMEM pH 7.4 또는 Seahorse XF RPMI pH 7.4 이외의 어세이 배지를 사용하는 경우 이러한 항목이 필요합니다)
관련 지원 자료
- 교육 웨비나: 어세이 재료 수집
- Seahorse XF 센서 카트리지 및 조직 배양 마이크로플레이트
- Seahorse XF 어세이 키트 및 시약
- 소모품 가이드
- 소모품 가이드
- 소모품 가이드
- 소모품 가이드
- Seahorse XF HS Mini 소모품 주문 가이드
- Seahorse XF 배지 및 완충액 선택 가이드
- XF 어세이 배지 준비
- XF 어세이 배지 준비
- 세포 특성 규명: XFe96/XF96 분석기 및 Seahorse XF Real-Time ATP 생성률 어세이
- 세포 특성 규명: XFe24 분석기 및 Seahorse XF Real-Time ATP 생성률 어세이
- 세포 특성 규명: XFp 분석기 및 Seahorse XFp Real-Time ATP 생성률 어세이
- 세포 특성 규명: XF HS Mini 분석기 및 XF Real-Time ATP 생성률 어세이
- 세포 특성 규명: HS miniplate와 XF Real-Time ATP 생성률 어세이를 갖춘 XF HS Mini 분석기
참고 자료
- Agilent Seahorse 어세이 가이드 및 템플릿
- Agilent Seahorse 어세이 가이드 및 템플릿
- Agilent Seahorse 어세이 가이드 및 템플릿
- Agilent Seahorse 어세이 가이드 및 템플릿
- Agilent Seahorse 어세이 가이드 및 템플릿
- Agilent Seahorse 템플릿
- 애질런트 세포 분석 발행물 데이터베이스
Agilent Cell Analysis 데이터를 사용하여 발행물의 전체 목록을 살펴보세요.
Seahorse에 대한 정보만 표시
기기 유형 변경2. XF 어세이 준비
이 섹션에서는 세포 분주 밀도 선택에 대한 가이드, XF 조직 배양 플레이트에 부착 세포를 분주하는 기술 및 XF 카트리지 수화 기술을 포함하여 XF 어세이 전날의 준비 기술에 중점을 둡니다.
이 섹션에서는 세포 분주 밀도 선택에 대한 가이드, 조직 배양 플레이트에 부착 세포를 분주하는 기술 및 XFp 카트리지 수화 기술을 포함하여 XFp 어세이 전날의 준비 기술에 중점을 둡니다.
이 섹션에서는 세포 분주 밀도 선택에 대한 가이드, XFp miniplate, XF HS miniplate, 또는 XF HS PDL miniplate에 부착 세포를 분주하는 기술 및 8웰 센서 카트리지 수화 기술을 포함하여 XF 어세이 전날의 준비 기술에 중점을 둡니다.
참고: XF HS Mini 어세이 실행과 관련된 단계의 개요는 워크플로 다이어그램을 참조하세요.
도움말 콘텐츠를 표시하려면 워크플로 단계를 선택하세요.
2.5 XFp PDL 또는 XF HS PDL miniplate 준비(부유 세포만 해당)
XFp 또는 XF HS miniplate를 사용한 어세이 수행 개요.
2.1 세포 분주 밀도 선택
세포 분주 밀도 선택을 위한 기본 절차
Agilent Seahorse 세포 외 흐름(flux)분석기, 분석기를 사용하여 대사 및 생체 에너지 기능을 효과적으로 검사하려면 먼저 기초 및 최대 호흡 능력(OCR) 및 외 산성화(ECAR)에서의 대사 활동과 관련하여 특정 세포 유형의 특성을 규명하는 것이 필수적입니다. Seahorse XF Real-Time ATP 생성률 어세이 측정 키트 Seahorse XFp Real-Time ATP 생성률 어세이 측정 키트를 사용하면 두 번의 짧은 어세이에서 단일 어세이로 관심 있는 세포주/유형의 특성을 규명할 수 있습니다.
최적의 세포 분주 수는 세포 유형에 따라 다르지만 일반적으로 부착 세포의 경우 웰당 5 x 103-4 x 104 세포 사이입니다. 부유 세포는 세포 유형에 따라 웰당 5 x 104-2 x 105 세포의 더 높은 분주 밀도가 필요합니다. 웰당 1 x 104 및 8 x 104 세포. 일반적으로 50-90% 합류 지점을 초래하는 밀도는 기기의 적합한/측정 범위에서 대사율을 생성합니다.
최적의 세포 분주 수는 세포 유형과 플레이트 유형에 따라 다릅니다. 일반적으로 50-90% 합류 지점을 초래하는 밀도는 기기의 작합한/측정 범위에서 대사율을 생성합니다. 자세한 내용은 표를 참조하세요.
XF HS miniplate 및 XF HS PDL miniplate의 경우, 부착 세포의 경우 최적의 세포 분주 수는 일반적으로 웰당 1.0 × 103-1.0 × 104 세포 사이입니다. 부유 세포는 세포 유형에 따라 웰당 2.0 x 104 - 7.0 x 104 세포의 더 높은 분주 밀도가 필요합니다.
XFp miniplate 및 XFp PDL miniplate의 경우, 부착 세포의 경우 최적의 세포 분주 수는 일반적으로 웰당 5 x 103-4 x 104 세포 사이입니다. 부유 세포는 세포 유형에 따라 웰당 5 x 104-2 x 105 세포의 더 높은 분주 밀도가 필요합니다.
용도에 맞는 세포 밀도 값의 초기 시작점을 찾으려면 애질런트 세포 분석 발행물 데이터베이스를 참조하세요.
| 플레이트 유형 | 최적의 세포 분주 수(세포/웰) | |
|---|---|---|
| 부착 세포 | 부유 세포 | |
| XF HS miniplate / XF HS PDL miniplate | 1.0 × 103-1.0 × 104 | 2.0 × 104 – 7.0 × 104 |
| XFp miniplate/XFp PDL miniplate | 5 × 103 – 4 × 104 | 5 × 104 – 2 × 105 |
세포 분주 밀도 선택을 위한 기본 절차
Agilent Seahorse 세포 외 흐름(flux) 분석기를 사용하여 대사 및 생체 에너지 기능을 효과적으로 검사하려면 먼저 기초 및 최대 호흡 능력(OCR) 및 세포 외 산성화(ECAR)에서의 대사 활동과 관련하여 특정 세포 유형의 특성을 규명하는 것이 필수적입니다. Seahorse 세포 에너지 표현형 테스트 키트를 사용하면 두 번의 짧은 어세이에서 관심 있는 세포주/유형의 특성을 규명할 수 있습니다.
최적의 세포 분주 수는 세포 유형에 따라 다르지만 일반적으로 웰당 1 x 104-8 x 104 세포 사이입니다. 일반적으로 50-90%의 합류 지점을 초래하는 밀도는 기기의 적합한/측정 범위에서 대사율을 생성합니다.
용도에 맞는 세포 밀도 값의 초기 시작점을 찾으려면 애질런트 세포 분석 발행물 데이터베이스를 참조하세요.
관련 지원 자료
- XF 어세이 준비
- 관심 세포 알아보기: 성공적인 XF 경험을 위한 조언 및 제안
- 세포 에너지 표현형 테스트 소개
- 세포 특성 규명: XFe96/XF96 분석기 및 Seahorse XF Real-Time ATP 생성률 어세이
- 세포 특성 규명: XFe24 분석기 및 Seahorse XF Real-Time ATP 생성률 어세이
- 세포 특성 규명: XF24 분석기 및 세포 에너지 표현형 테스트
- 세포 특성 규명: XFp 분석기 및 Seahorse XF Real-Time ATP 생성률 어세이
- 세포 특성 규명: XF HS Mini 분석기 및 XF Real-Time ATP 생성률 어세이
- 세포 특성 규명: HS miniplate와 XF Real-Time ATP 생성률 어세이를 갖춘 XF HS Mini 분석기
- Seahorse XF Real Time ATP 생성률 어세이 사용자 가이드
- 기술 개요: 세포 특성 규명 - OCR 값을 사용하여 최적의 분주 밀도 결정
참고 자료
- Agilent Seahorse 어세이 가이드 및 템플릿
- Agilent Seahorse 어세이 가이드 및 템플릿
- Agilent Seahorse 어세이 가이드 및 템플릿
- Agilent Seahorse 어세이 가이드 및 템플릿
- Agilent Seahorse 어세이 가이드 및 템플릿
- Agilent Seahorse 템플릿
- 애질런트 세포 분석 발행물 데이터베이스
Agilent Cell Analysis 데이터를 사용하여 발행물의 전체 목록을 살펴보세요.
2.2 카트리지 수화
8웰 센서 카트리지 수화를 위한 기본 절차
참고: XFp 센서 카트리지는 XF HS Mini 분석기와 호환됩니다.
XFp HS Mini 어세이 플랫폼의 중요한 구성 요소는 센서 카트리지입니다. 센서 카트리지의 각 probe tip은 고체상 센서 물질에 설치되며, pH와 O2 농도의 시간에 따른 변화를 감지해 그 비율을 계산하게 됩니다. 센서가 정확하게 작동하려면 완전히 수화되어야 합니다.
XFp HS Mini 어세이 전날:
- 50mL 코니칼 튜브에 최소 20mL의 XF 캘리브레이션 용액을 배분합니다. non-CO2 37°C 인큐베이터에 밤새 둡니다.
- 15mL 코니칼 튜브에 최소 5mL의 XF 캘리브레이션 용액을 배분합니다. non-CO2 37°C 인큐베이터에 밤새 둡니다.
- 세포 외 흐름(flux) 어세이 키트를 열고 내용물을 제거합니다.
- 녹색 상자에서 카트리지 3팩을 가져옵니다. 사용할 튜브에서 호일 씰을 제거합니다.
- 센서 카트리지를 뒤집어 유틸리티 플레이트 옆에 놓습니다.
- 유틸리티 플레이트와 센서 카트리지를 분리하고, 센서 카트리지를 뒤집어 유틸리티 플레이트 옆에 놓습니다.
- 유틸리티 플레이트의 각 웰에 200μL의 멸균 조직 배양 등급 물을 채웁니다.
- 챔버당 400μL로 웰 외부 주변의 moat를 채웁니다.
- 센서 카트리지를 유틸리티 플레이트 위로 내리고 센서를 물에 담급니다.
- 물의 높이가 센서를 잠기게 할 만큼 충분히 높은지 확인합니다.
- non-CO2 37°C의 인큐베이터에 밤새 둡니다. 수분 증발을 방지하기 위해 인큐베이터가 적합하게 가습되었는지 확인합니다.
- 센서 카트리지 수화 프로토콜은 학습 센터의 섹션 3.1에 계속 이어집니다.
- Agilent Seahorse Flux 어세이 키트를 열고 내용물을 제거합니다.
- 센서 카트리지를 뒤집어 유틸리티 플레이트 옆에 놓습니다.
- 유틸리티 플레이트의 각 웰에 1mL를 XF 캘리브레이션 용액을 채웁니다.
- 유틸리티 플레이트 위에 하이드로부스터를 올려 놓습니다.
- 센서 카트리지를 하이드로부스터 플레이트의 입구를 통해 유틸리티 플레이트로 내려 XF 캘리브레이션 용액에 센서를 담급니다.
- 센서 카트리지를 유틸리티 플레이트 위로 내리고 센서를 물에 담급니다.
- XF 캘리브레이션 용액의 높이가 센서를 잠기게 할 만큼 충분히 높은지 확인합니다.
- non-CO2 37°C 인큐베이터에 밤새 둡니다. XF 캘리브레이션 용액의 증발을 방지하려면 인큐베이터를 가습해야 합니다.
- 중요 참고 사항: 센서 카트리지를 Agilent Seahorse 분석기에 배치하기 전에 하이드로부스터를 제거해야 합니다. 그렇지 않으면 센서 카트리지와 분석기가 모두 손상될 수 있습니다. 자세한 가이드는 섹션 3을 참조하세요.
관련 지원 자료
- Agilent Seahorse XFe96 센서 카트리지 수화 방법
- Agilent Seahorse XFe24 센서 카트리지 수화 방법
- Agilent Seahorse XF24 센서 카트리지 수화 방법
- Agilent Seahorse XFp 센서 카트리지 수화 방법
- 세포 특성 규명: XFe96/XF96 분석기 및 Seahorse XF Real-Time ATP 생성률 어세이
- 세포 특성 규명: XF24 분석기 및 세포 에너지 표현형 테스트
- 세포 특성 규명: XFe24 분석기 및 Seahorse XF Real-Time ATP 생성률 어세이
- 세포 특성 규명: XFp 분석기 및 Seahorse XF Real-Time ATP 생성률 어세이
참고 자료
- Agilent Seahorse 어세이 가이드 및 템플릿
- Agilent Seahorse 어세이 가이드 및 템플릿
- Agilent Seahorse 어세이 가이드 및 템플릿
- Agilent Seahorse 어세이 가이드 및 템플릿
- Agilent Seahorse 어세이 가이드 및 템플릿
- Agilent Seahorse 템플릿
- 애질런트 세포 분석 발행물 데이터베이스
Agilent Cell Analysis 데이터를 사용하여 발행물의 전체 목록을 살펴보세요.
2.3 실험 설계
Wave DesktopPro 소프트웨어를 사용하면 어세이 템플릿 파일을 쉽게 생성하고 사용자 지정하여 Seahorse 분석기에서 실행할 수 있습니다.
어세이 템플릿 파일이란 무엇입니까? 어세이 템플릿 파일을 실험실 노트북에서 설계한 실험의 전자 사본이라고 생각하시면 됩니다. 어세이 템플릿 파일에 입력된 정보는 결과 파일 내의 실험 기록으로 저장되어 사용자 또는 다른 공동 작업자가 공유하고 다시 실행할 수 있으며 어세이 완료 후 결과 데이터에 구조 및 구성을 제공하고 귀중한 정보를 제공하고 필요할 때 유용한 문제해결 정보를 제공할 수 있습니다.
어세이 템플릿 파일의 3가지 요소는 다음과 같습니다.
- 그룹 정의
- 플레이트 맵
- 기기 프로토콜
그룹 정의
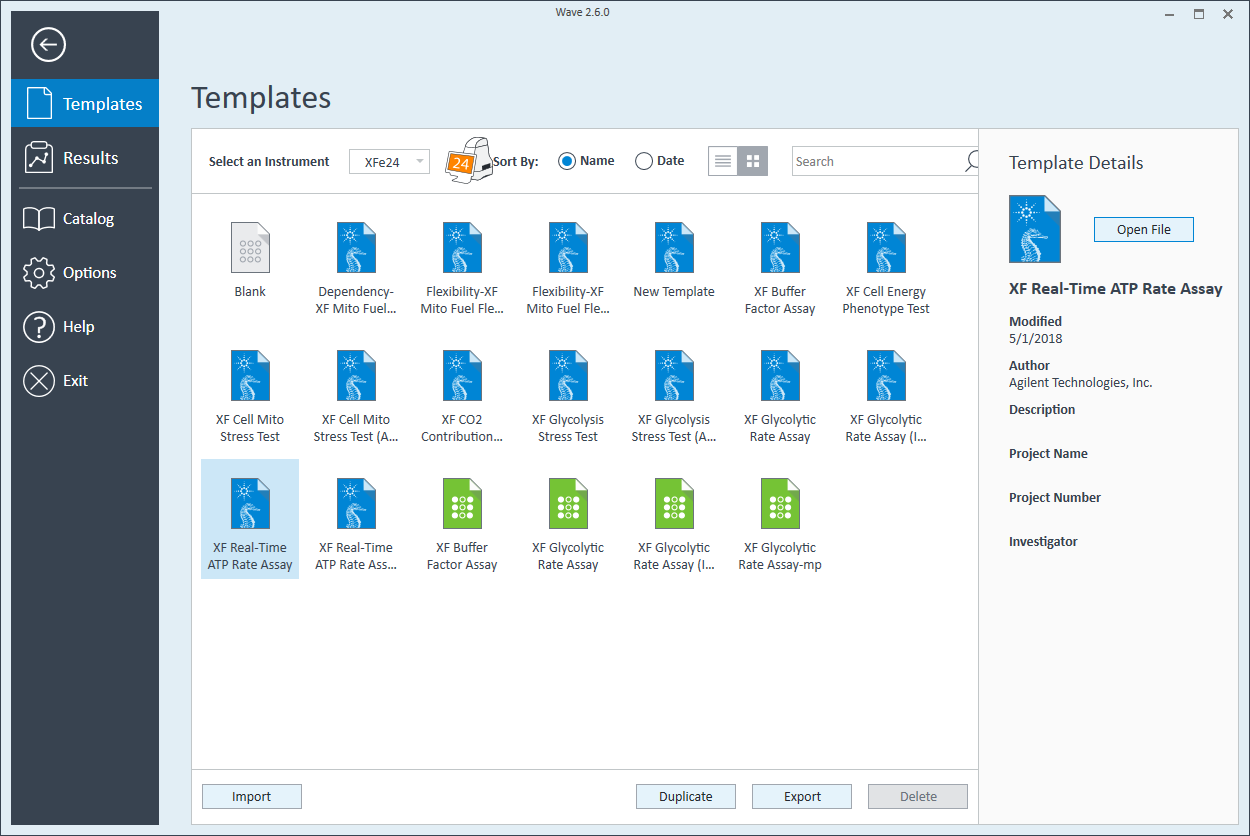
- Open Wave 2.6Pro 소프트웨어
- Templates(템플릿)(Wave Home 아래에 위치)을 클릭합니다
- XF Real-Time ATP 생성률 어세이라는 어세이 템플릿을 엽니다
- Group Definitions(그룹 정의) 보기에서, 주입 전략, 전처리, 어세이 배지 및 세포 유형에 대한 미리 지정된 정보를 볼 수 있습니다.
- Pretreatments(전처리)를 더블 클릭하고 대조군 및 실험 항목을 삭제합니다.
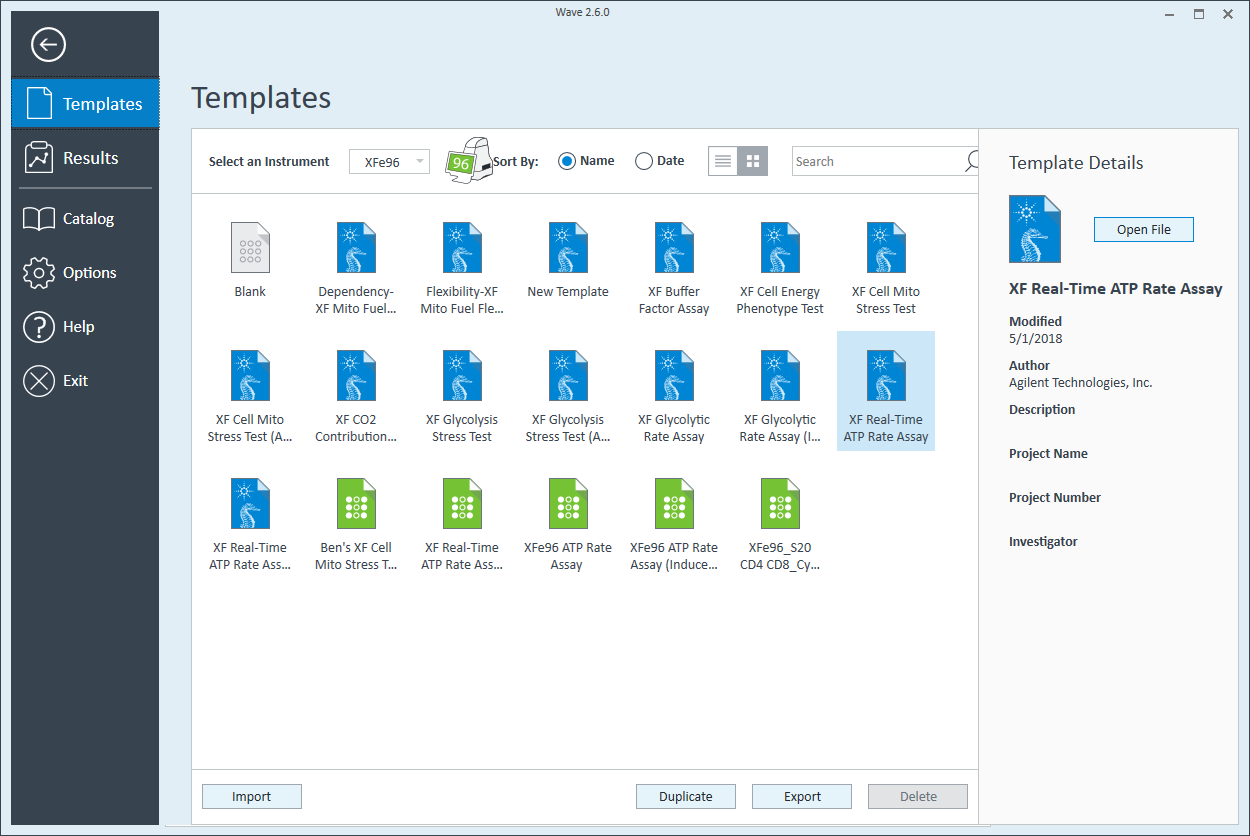
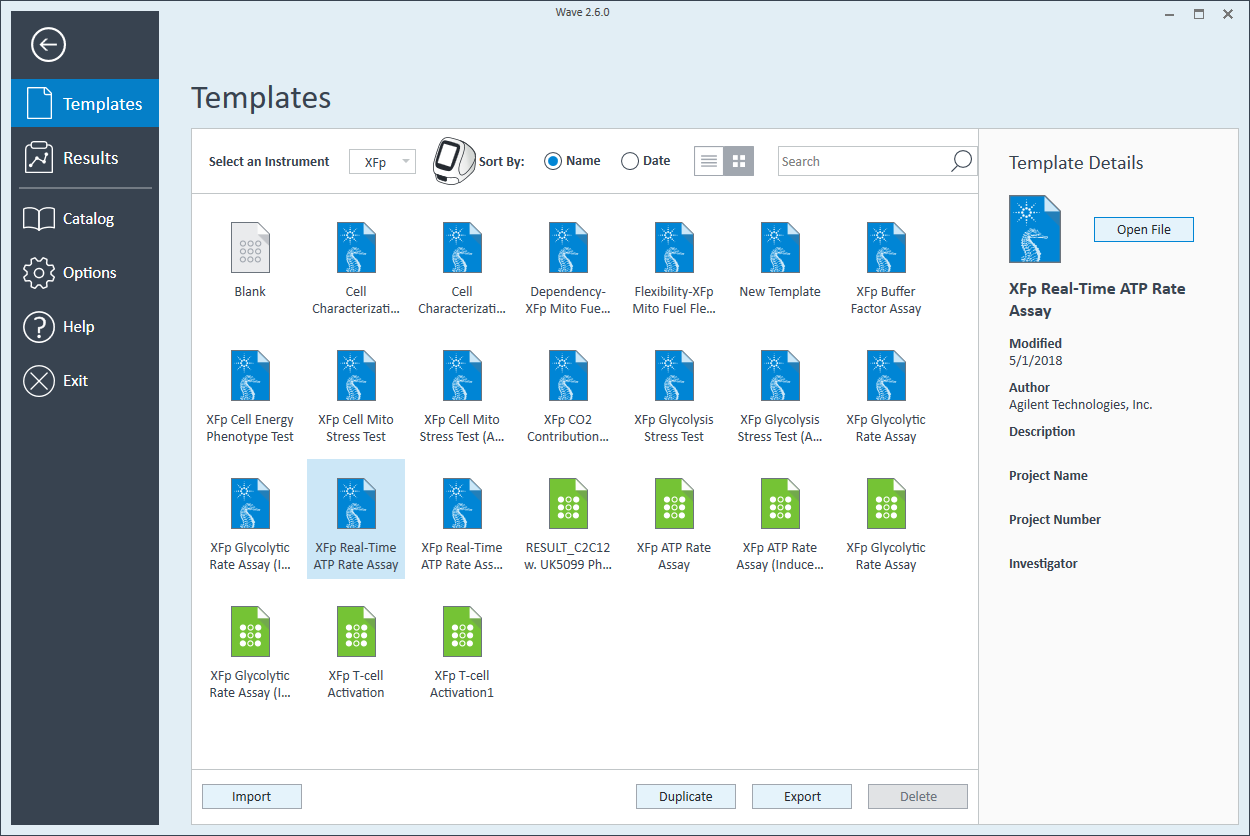
- Cell Type(세포 유형)을 더블 클릭하고 세포라는 기본 항목을 삭제합니다(Agilent 세포 분석 발행물 데이터베이스 참조).
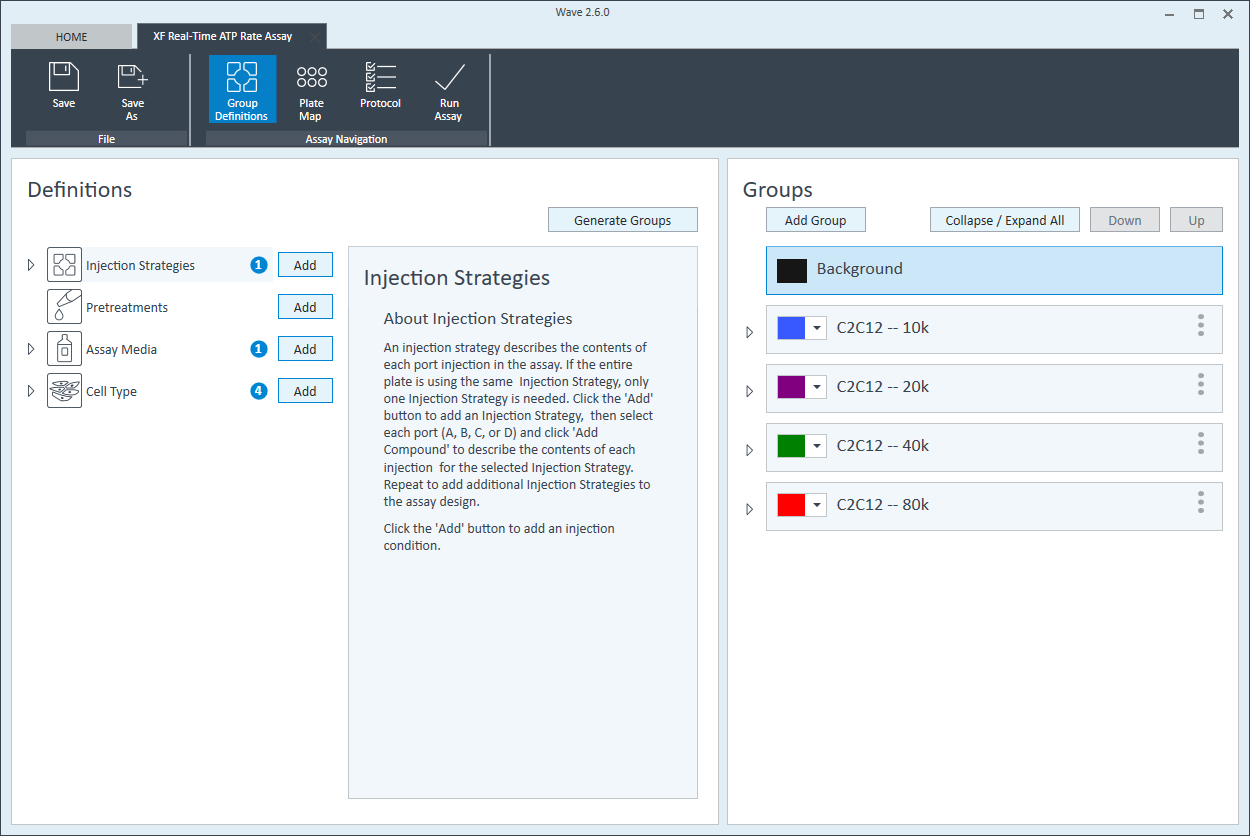
- 세포 유형 그룹 정의에서 Cell Type(세포 유형) 및 Add(추가)를 클릭하여 새 세포 유형 항목을 추가하고 어세이에서 분석하려는 세포 유형의 이름을 입력합니다. 그룹 이름에 분주 밀도를 추가할 것을 권장합니다. 예를 들어 웰당 분주 밀도가 20,000세포인 C2C12 세포 유형은 20k C2C12로 명명됩니다
각 세포 유형 정의에 대해 3번 반복합니다.
참고: XFe24 분석기의 24웰 마이크로플레이트 형식으로 인해 이 세포 분주 밀도 최적화 프로토콜은 4개의 세포 분주 밀도(그룹당 n=5)의 1개의 세포 플레이트를 사용하여 수행할 수 있습니다. XFe96 분석기의 96웰 마이크로플레이트 형식으로 인해 이 세포 분주 밀도 최적화 프로토콜은 4개의 세포 분주 밀도(그룹당 n=22-24)의 1개의 세포 플레이트를 사용하여 수행할 수 있습니다. 분석기의 8웰 miniplate 형식으로 인해 이 세포 분주 밀도 최적화 프로토콜은 플레이트당 2개의 세포 분주 밀도(그룹당 n=3)의 2개의 세포 플레이트를 사용하여 수행되어야 합니다. 어세이 템플릿을 설계할 때 다음을 수행할 수 있습니다.- 세 번째 및 네 번째 세포 분주 밀도 그룹에 대한 새로운 어세이 템플릿을 생성합니다.
- 하나의 어세이 템플릿에 4개의 세포 분주 밀도 그룹을 추가하고 세포 분주 밀도 그룹 1과 2로 첫 번째 어세이를 수행한 후 플레이트 맵에 세 번째 및 네 번째 세포 그룹을 다시 할당합니다.
- 세포 분주 밀도 그룹 1과 2로 첫 번째 어세이를 수행한 후 이 템플릿에서 그룹의 이름을 재지정합니다.
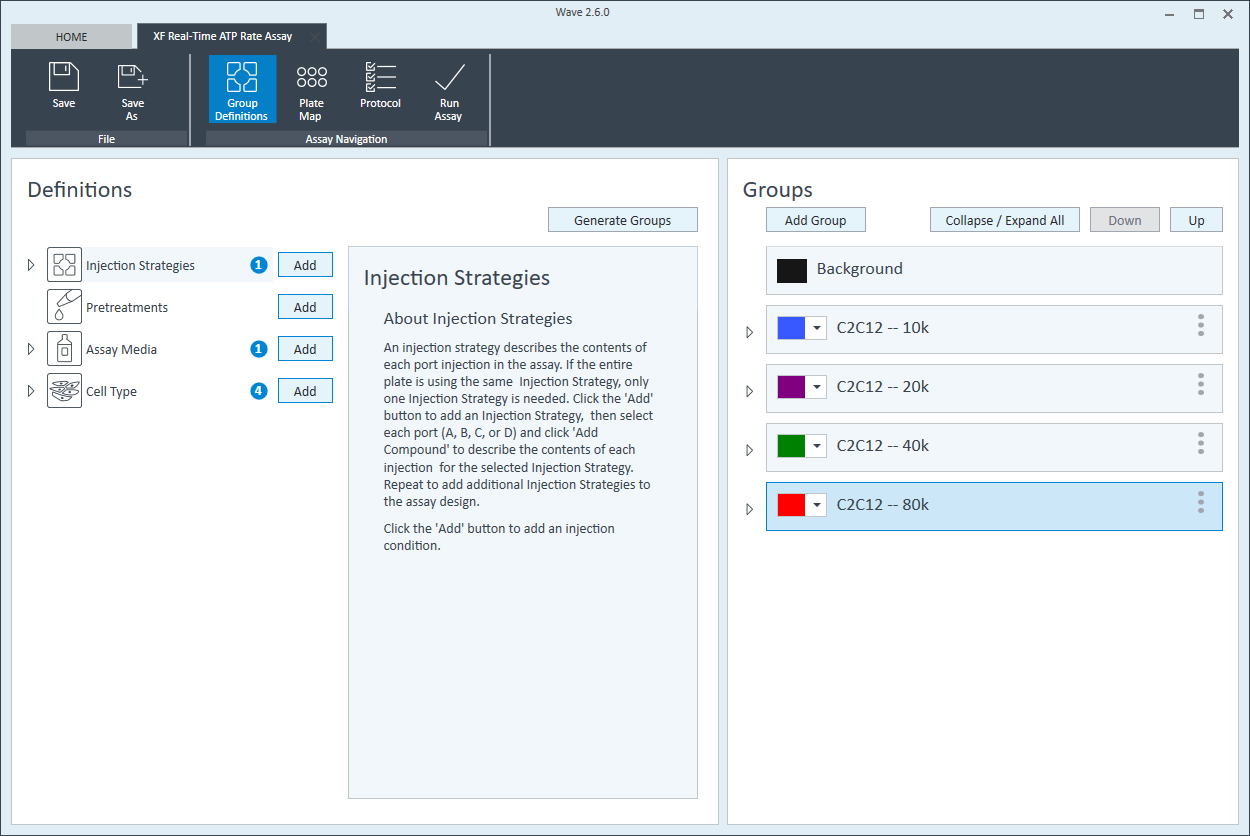
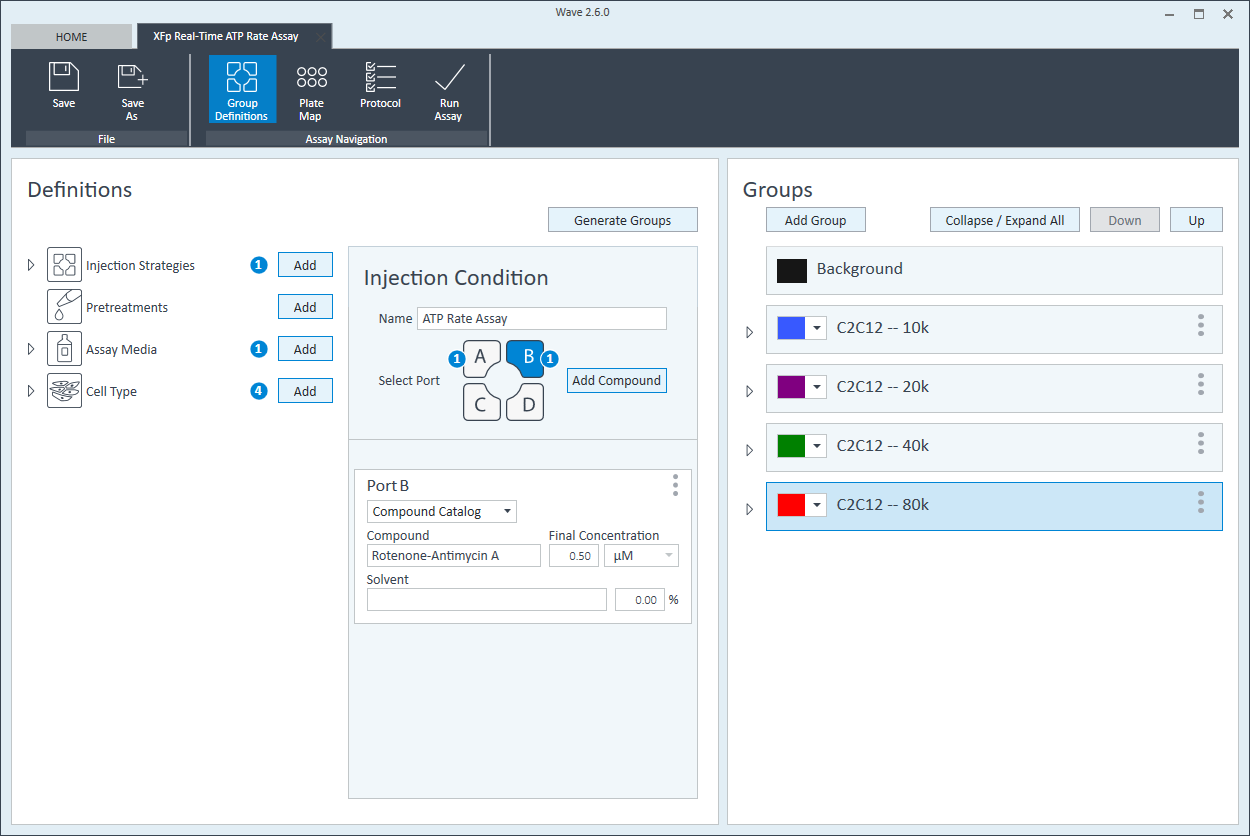
- 그룹 이름을 지정한 후 Generate Groups(그룹 생성)을 클릭하면 Wave가 4개의 고유한 어세이 그룹을 자동으로 생성합니다. 그룹 이름에는 간소화된 플레이트 맵 할당을 위한 세포 유형과 분주 밀도가 포함됩니다.
다음 단계는 플레이트 맵에 그룹을 할당하는 것입니다.
플레이트 맵
- 기능 리본(“어세이 탐색” 아래)에서 Plate Map(플레이트 맵)을 클릭합니다.
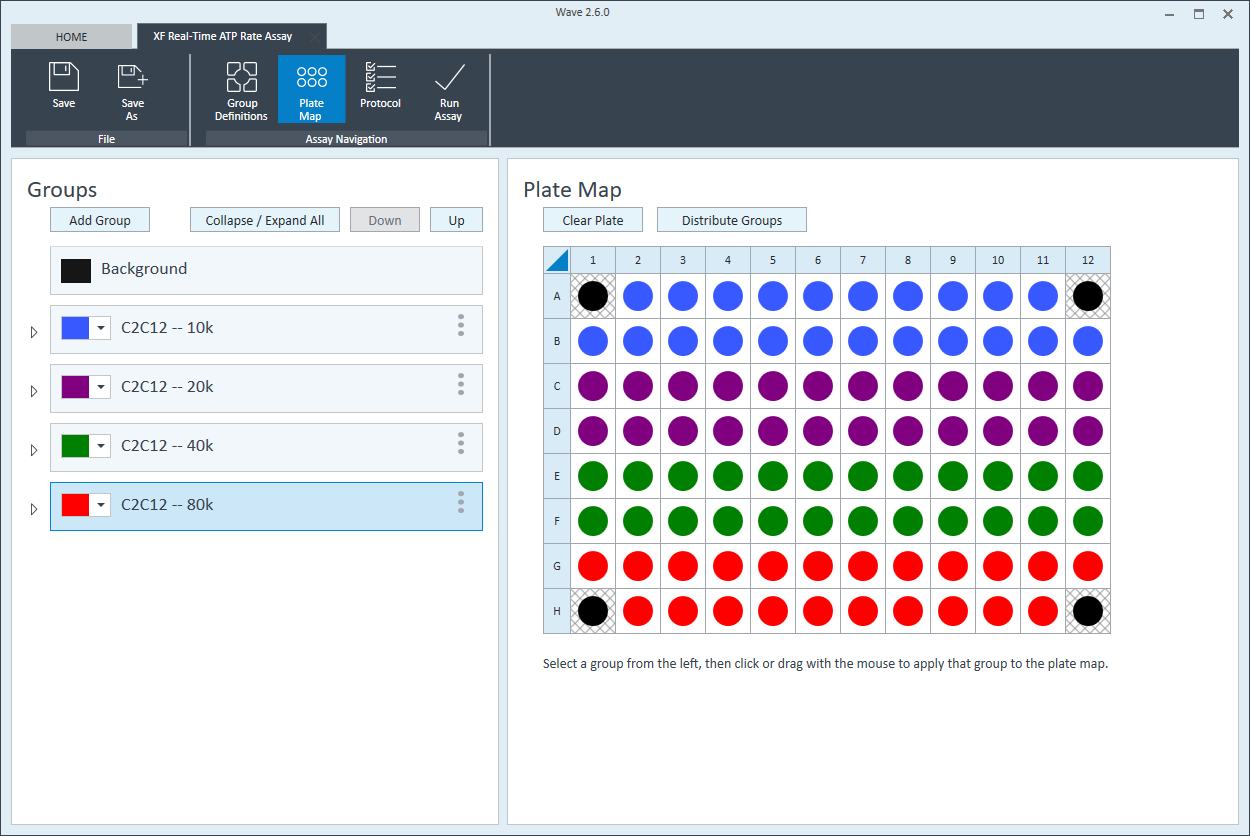
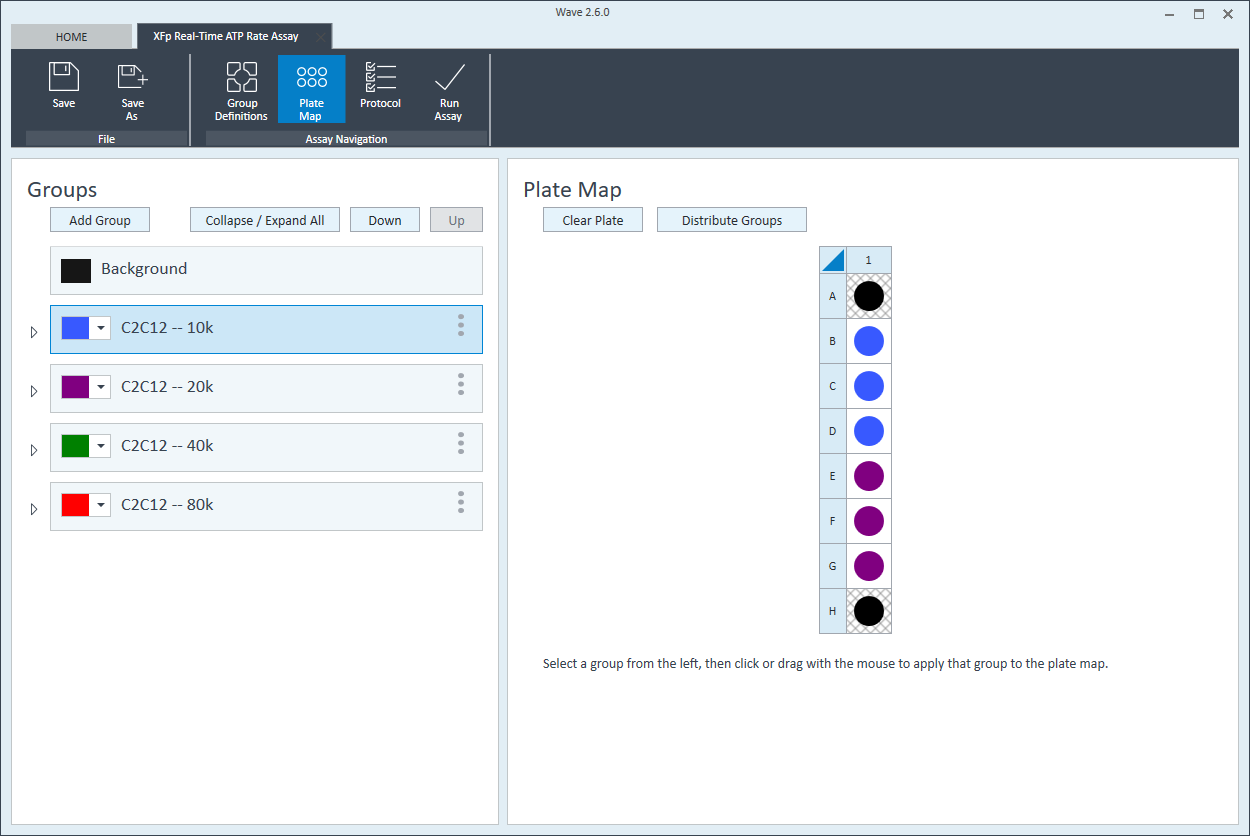
- 첫 번째 세포 분주 밀도 그룹을 플레이트 맵에 할당합니다. 플레이트 맵에 그룹을 할당하려면 먼저 그룹 목록에서 그룹 이름을 클릭한 후 다음을 수행합니다.
- 열 머리글(예: 1, 2, 3 등) 또는 행 머리글(예: A, B, C 등)을 클릭합니다.
- 마우스 왼쪽 버튼을 클릭하여 플레이트 맵에 웰 영역을 끌어다 놓습니다.
- 플레이트 맵에서 개별 웰을 클릭합니다.
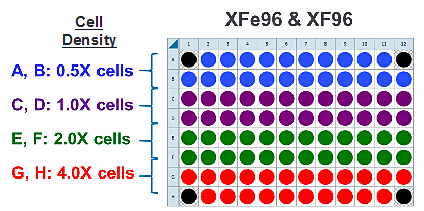
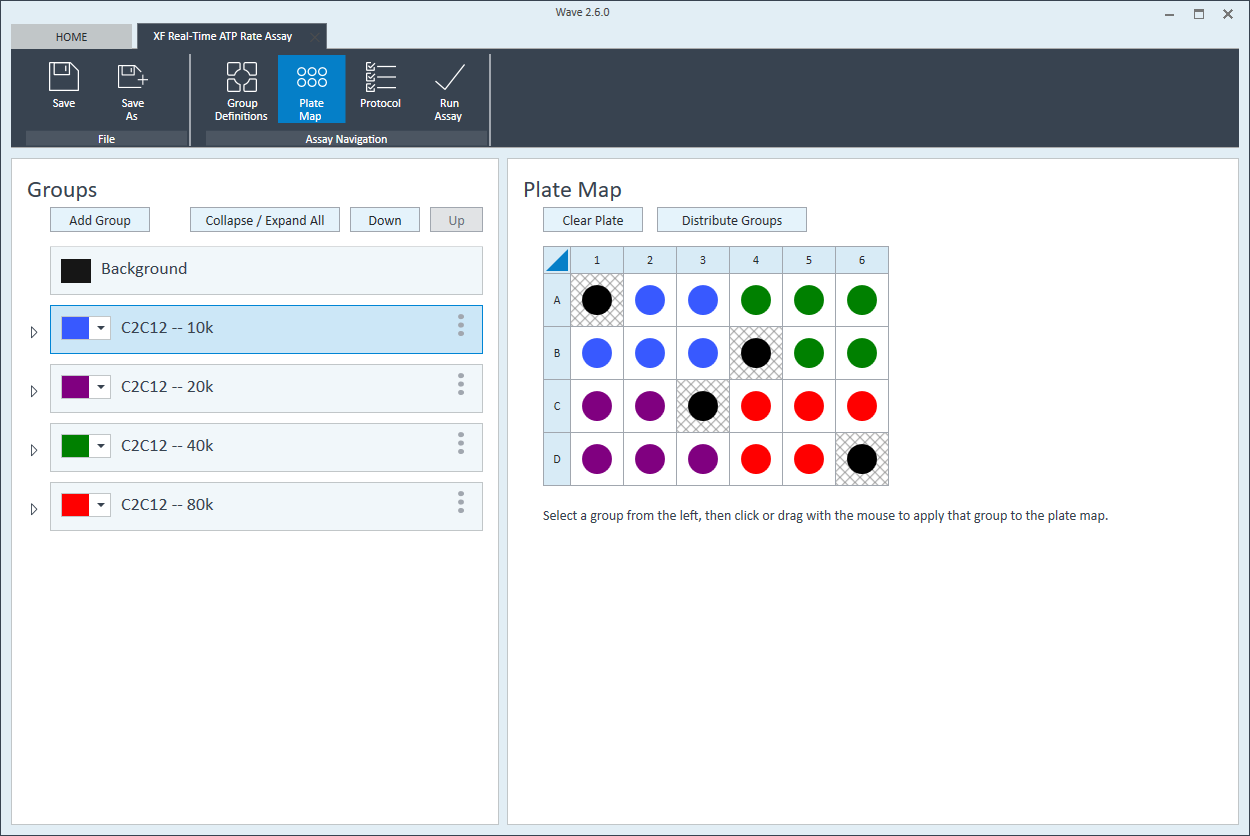
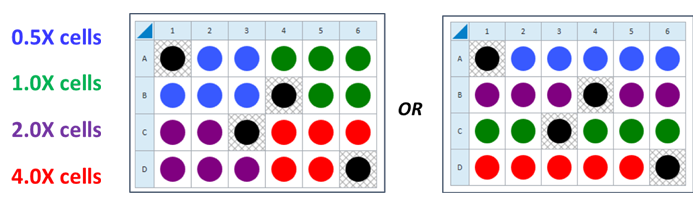
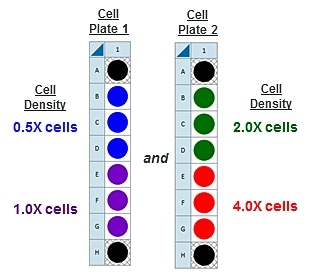
- 다음 세포 분주 밀도 그룹에 대해 반복합니다. 제안된 플레이트 맵 레이아웃은 위/아래 그림과 같습니다.
기기 프로토콜
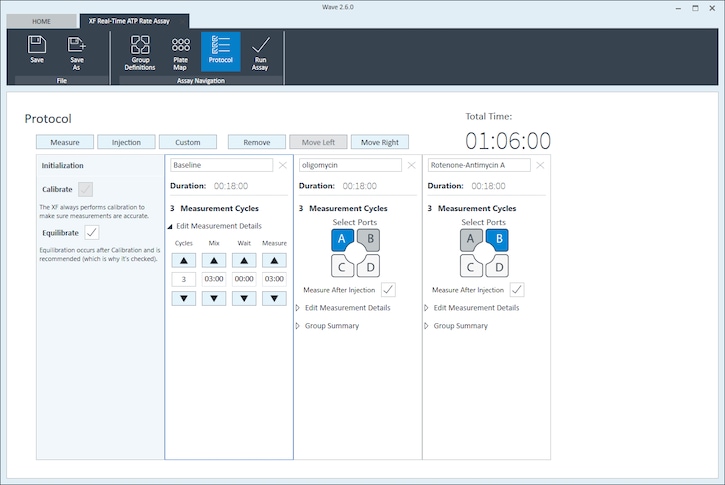
- 기능 리본(“어세이 탐색” 아래)에서 Instrument Protocol(기기 프로토콜)을 클릭하여 기기 프로토콜을 보거나 편집합니다.
참고: 기본 기기 프로토콜은 수정이 필요하지 않지만 프로토콜 명령의 이름, 주입 전/후의 측정 횟수 또는 각 측정이 수행되는 시간을 변경할 수 있습니다.- 기기 프로토콜 설정을 수정하면 어세이 중에 데이터가 수집되는 방식에 직접적인 영향을 미칩니다. 이 예에서는 기본 기기 프로토콜이 사용됩니다(권장됩니다).
- 기본 기기 프로토콜을 수정해야 하는 경우, 세포 분주 밀도 최적화 에세이를 수행하기 전에 Wave 사용자 가이드의 기기 프로토콜 섹션을 검토하거나 필요한 경우 애질런트 세포 분석 기술 지원팀에 문의하세요.
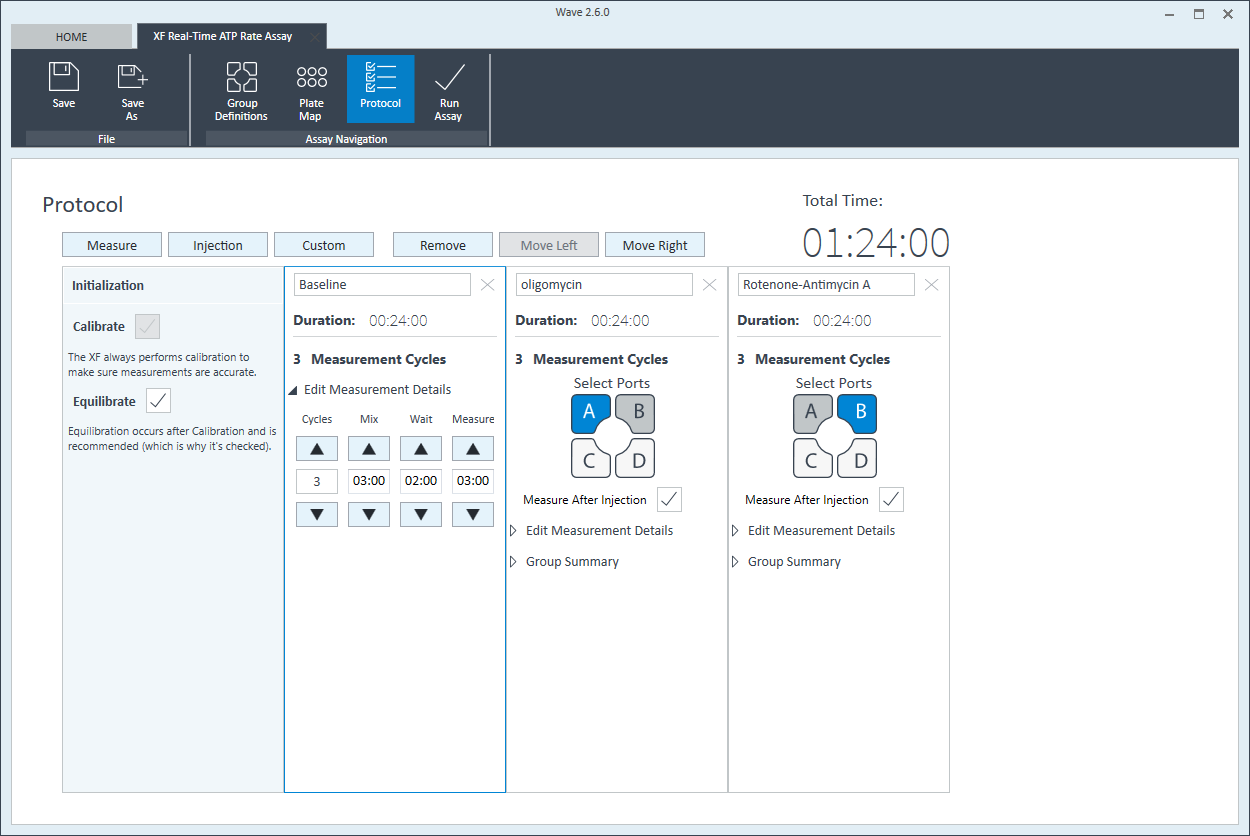
- 마지막으로, 기능 리본(“어세이 탐색” 아래)에서 Run Assay(어세이 수행)를 클릭하여 실험 세부 정보를 추가하고 템플릿 파일을 저장한 다음 세포 분주 밀도 최적화 어세이를 시작합니다.
- 기능 리본(“어세이 탐색” 아래)에서 Run Assay(어세이 수행)를 클릭하여 실험 세부 정보를 추가하고 템플릿 파일을 저장합니다.
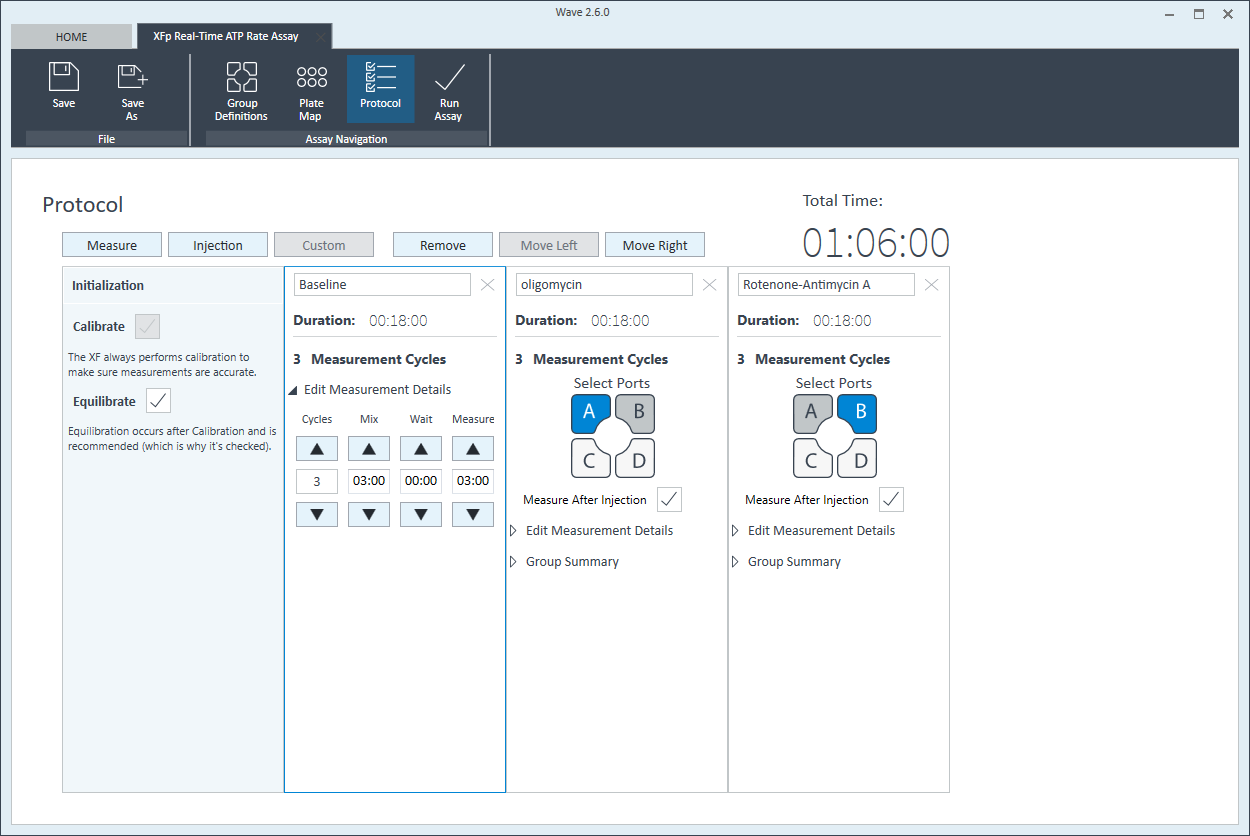
- 첫 번째 세포 분주 밀도 최적화 어세이를 수행하려면 XFp 세포 외 흐름(flux) 사용자 가이드에 설명된 단계에 따라 어세이 템플릿 파일을 XFp 분석기로 전송합니다.
- 첫 번째 세포 분주 밀도 최적화 어세이를 수행하려면 XF HS Mini 세포 외 흐름(flux) 사용자 가이드에 설명된 단계에 따라 어세이 템플릿 파일을 XF HS Mini 분석기로 전송합니다.
2.4 세포 분주
2.3 세포 분주
부착 세포 분주를 위한 기본 절차(일반적으로 XFp HS Mini 어세이 전날 수행)
테스트할 각 밀도에 대해 부착 세포에 대해 가이드에 따라 분주합니다. 부유 세포 분주에 대한 가이드를 확인하세요.
Agilent Seahorse XFp HS Mini 어세이는 센서 카트리지와 함께 Agilent Seahorse 96웰 24웰 8웰 XFp 세포 배양 마이크로플레이트 세포 배양 Miniplatep, XF HS, XFp PDL, 또는 XF HS PDL miniplate에서 수행합니다. XFe96 센서 카트리지. 8웰 센서 카트리지. 이 절차에서는 Agilent Seahorse 분석기와 함께 사용하기 위한 부착 세포 유형 분주에 대한 권장 사항을 설명합니다. 부유 세포 분주에 대한 가이드를 확인하세요.
초기 어세이에는 기기와 함께 XF96 세포 배양 플레이트, XFe96 카트리지 및 Seahorse XF Real-Time ATP Rate Assay 키트를 사용하여 4가지 서로 다른 세포 밀도에 대한 분석법이 권장됩니다.
초기 어세이에는 기기와 함께 2개의 세포 배양 플레이트, 2개의 카트리지 및 XF 세포 에너지 표현형 테스트 키트를 사용하여 4개의 서로 다른 세포 밀도와 4개의 서로 다른 FCCP 농도를 테스트하는 분석법이 권장됩니다.
초기 어세이에는 기기와 함께 XF24 세포 배양 마이크로플레이트, XFe24 센서 카트리지 및 Seahorse XF Real-Time ATP Rate Assay 키트를 사용하여 4가지 서로 다른 세포 밀도를 테스트하는 분석법이 권장됩니다.
초기 어세이에는 XFp 기기XF HS Mini 분석기와 함께 XFp 세포 배양 Miniplate, XFp 8웰 센서 카트리지 및 Seahorse XF Real-Time ATP Rate Assay 키트를 사용하여 2-4가지 서로 다른 세포 밀도를 테스트하는 분석법이 권장됩니다.
이는 4가지 세포 밀도를 분주하기 위해 제안된 XF96 어세이 플레이트 맵입니다.
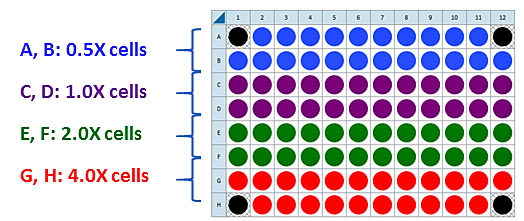
세포 밀도 적정 어세이를 위한 분주
이는 4가지 세포 밀도를 분주하기 위해 제안된 어세이 플레이트 맵입니다.
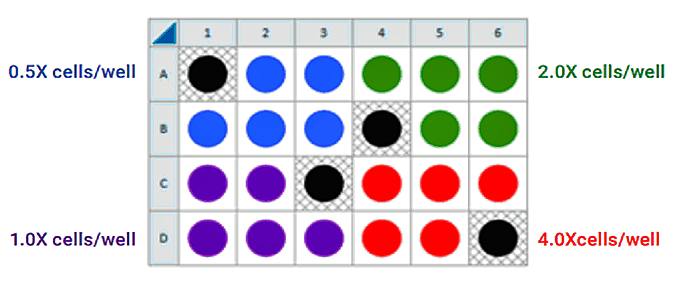

FCCP 농도 적정 어세이를 위한 분주
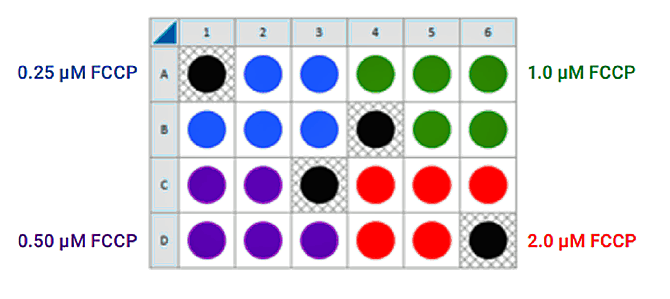
이미 세포 분주 밀도 어세이를 수행했거나 및/또는 웰당 최적의 세포 수를 알고 있는 경우 백그라운드 보정 웰을 제외한 모든 웰에 분주된 최적의 세포 수(1.0 X 세포/웰)를 사용하여 FCCP 적정 어세이를 수행할 수 있습니다. 그렇지 않으면 아래와 같이 세포 분주 및 카트리지 수화/준비에 대한 동일한 가이드를 따르고 FCCP의 4가지 농도를 테스트하기 위해 다음 제안 플레이트 레이아웃을 사용하세요.
두 가지 워크플로 옵션이 있습니다. (1) 수에 제한이 없는 세포의 경우 여러 XFp 세포 배양 miniplate를 서로 다른 밀도로 분주하여 실험 간 시간을 줄이고 특성 규명 워크플로를 더 빠르게 완료할 수 있습니다(가속화된 워크플로). (2) 수가 제한된 세포의 경우, 첫 번째 실험 결과가 확인된 후 추가 세포를 준비합니다(표준 워크플로). 관찰된 세포 밀도와 계산된 기본 비율에 따라 다음 세포 수 최적화 어세이에는 더 많거나 더 적은 세포가 필요합니다.
| 실험 | 근거 | 가속화된 워크플로 | 표준 워크플로 |
|---|---|---|---|
| 단일 또는 다른 밀도의 세포를 분주하고 세포 컨플루언스를 시각적으로 평가합니다. 다음 단계를 위해 miniplate를 선택합니다. | 기기의 측정 범위 내에서 대사율을 생성하려면 세포가 50-90% 합류해야 합니다. 시각적 평가는 최적의 세포 밀도에 대한 좋은 첫 번째 근사치이며 각 어세이에서 검증됩니다. | 아래 다이어그램에 따라 2-4개의 서로 다른 밀도로 1-2개의 miniplate를 분주합니다. | 단일 세포 밀도에서 1개 miniplate를 분주합니다. 1 XFp 카트리지를 수화합니다. |

2.4.1 XFp miniplate
- 위에 설명된 표준 또는 가속화된 워크플로를 기반으로 테스트할 2-4개의 세포 밀도를 선택합니다. 위의 참조에 있는 범위를 포괄하거나 권장 세포/웰 값(1X)과 웰당 0.5X, 2X 및 4X 세포를 분주합니다.
- 파란색 상자에서 miniplate 3팩을 꺼냅니다.
- 사용할 튜브에서 호일 씰을 제거합니다.
- 세포 배양 웰 주변의 moat에 멸균수 또는 PBS를 첨가합니다. 200μL로 설정된 8채널 피펫터를 사용하여 moat의 양쪽을 채웁니다(각 챔버에 2개의 팁이 들어갑니다). 멀티채널 피펫을 사용할 수 없는 경우, moat의 각 챔버에 400μL의 멸균수 또는 PBS를 채웁니다(총 3200μL).
- 웰 A와 H에 80μL의 성장 배지만(세포 없음) 추가합니다. 이는 백그라운드 보정 웰입니다.
- XFp miniplate의 경우 웰 A 및 H에 80μL의 성장 배지만(세포 없음) 추가합니다. 이는 백그라운드 보정 웰입니다.
- 세포를 수확하고 원하는 최종 농도로 재부유하여 80μL의 성장 배지에 분주합니다. 최적의 세포 분주 수는 매우 다양하지만 일반적으로 웰당 5×103-4×104 세포 사이이며 경험에 따라 결정해야 합니다. (예를 들어, 웰당 1 x 104세포의 경우 80μL당 세포 1 x 104= mL당 1.25 x 105세포를 재부유합니다.)
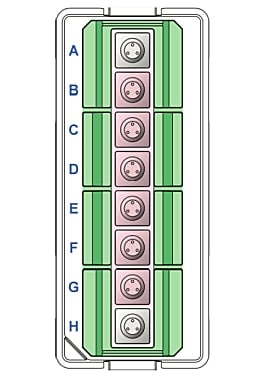
증발을 줄이기 위한 8개의 웰과 moat(녹색)가 특징인 Seahorse XFp miniplate
- 세포 분주 밀도 최적화 실험의 경우 위에 설명된 표준 또는 가속화된 워크플로를 기반으로 테스트할 2-4개의 세포 밀도를 선택합니다. 위의 참조에 있는 범위를 포괄하거나 권장 세포/웰 값(1X)과 웰당 0.5X, 2X 및 4X 세포를 분주합니다.
- 파란색 상자에서 miniplate 3팩을 꺼냅니다.
- 사용할 튜브에서 호일 씰을 제거합니다.
- 세포 배양 웰 주변의 moat에 멸균수 또는 PBS를 첨가합니다. 200μL로 설정된 8채널 피펫터를 사용하여 moat의 양쪽을 채웁니다(각 챔버에 2개의 팁이 들어갑니다). 멀티채널 피펫을 사용할 수 없는 경우, moat의 각 챔버에 400μL의 멸균수 또는 PBS를 채웁니다(총 3200μL).
- XFp miniplate의 경우 웰 A 및 H에 80μL의 성장 배지만(세포 없음) 추가합니다. 이는 백그라운드 보정 웰입니다.
- 세포를 채취하여 원하는 농도로 따뜻한 성장 배지에서 재부유합니다. 예시로 표를 보면, XFp miniplate에 웰당 1 x 104 세포가 필요한 경우 웰당 1 x 104 세포/80µL 또는 1.25 x 105 세포/mL가 되는 양으로 세포를 재부유합니다.
(A) 8개의 챔버(녹색), 6개의 시료 웰(B-G, 분홍색) 및 백그라운드 웰(A, H, 회색)이 있는 moat를 보여주는 Seahorse XFp miniplate의 다이어그램. (B) 세포 분주 영역(녹색 원)을 잘 보여주는 XFp miniplate의 단면 보기.
| 플레이트 유형 | 최종 부착 세포 분주 부피 | 최종 분주 밀도(예시) | mL로 환산 |
|---|---|---|---|
| XFp miniplate/ XFp PDL miniplate |
80μL | 1.0×104 세포/80μL | 1.25×105 세포/mL |
부착 세포 분주를 위한 기본 절차(일반적으로 XF 어세이 전날 수행)
- Agilent Seahorse XF24 세포 배양 마이크로플레이트를 분주할 때 2단계 분주 과정을 권장합니다. 2단계 과정을 통해 일관되고 균일한 세포 단층이 생성됩니다.
- 세포를 수집하고 원하는 최종 농도로 재부유하여 80μL의 성장 배지에 분주합니다. 최적의 세포 분주 수는 매우 다양하지만 일반적으로 웰당 5 × 103-4 × 104 세포 사이이며 경험에 따라 결정해야 합니다. (예를 들어, 웰당 1 x 104세포의 경우 80μL당 세포 1 x 104= mL당 1.25 x 105세포를 재부유합니다.)
- 세포를 수확하고 원하는 최종 농도로 재부유하여 100μL의 성장 배지에 분주합니다. 최적의 세포 분주 수는 매우 다양하지만 일반적으로 웰당 1×104-8×104 세포 사이이며 경험에 따라 결정해야 합니다. (예를 들어, 웰당 2 x 104세포의 경우 100μL당 세포 2 x 104= mL당 2.0 x 105세포를 재부유합니다.)
- 웰당 80μL의 세포 부유액을 분주합니다. 백그라운드 웰에는 세포를 분주하지 않습니다(A1, A12, H1, H12). 백그라운드 보정 웰에는 배지만(세포 없음) 넣어야 합니다.
- 웰 B-D에서 웰당 80μL의 세포 부유액을 분주합니다. 백그라운드 웰에는 세포를 분주하지 않습니다(A 및 H). 백그라운드 보정 웰에는 배지만(세포 없음) 넣어야 합니다.
- 웰당 80μL의 세포 부유액을 분주합니다. 백그라운드 웰 A와 H에는 세포를 첨가하지 않습니다. 웰 바닥에 기포가 관찰되면 플레이트를 200 x g에서 1-2분 동안 원심분리하여 기포를 제거할 수 있습니다.
- 웰당 100μL의 세포 부유액을 분주합니다. 백그라운드 웰에는 세포를 분주하지 않습니다(A1, B4, C3, D6). 백그라운드 보정 웰에는 배지만(세포 없음) 넣어야 합니다.
- 중요: 플레이트를 조직 배양 후드 내에서 실온 조건 하에 1시간 동안 안정되도록 둡니다.1 이는 균일한 세포 분포를 촉진하고 일부 세포 유형에 대한 엣지 효과를 줄일 수 있습니다. 현미경을 사용하여 부착성을 모니터링합니다.
- 세포가 부착될 수 있도록 표준 세포 배양 인큐베이터에 플레이트를 놓습니다. 일반적으로 접착력이 강한 부착 세포의 경우 약 1시간이 걸리지만 접착력이 약한 부착 세포 유형의 경우 5-6시간이 걸릴 수 있습니다. 현미경을 사용하여 부착성을 모니터링합니다.
- 1시간 안정 단계 후 세포의 부착 여부를 확인합니다.
- 세포가 잘 부착된 경우 각 웰에 150μL의 세포 성장 배지를 추가로 분주한 다음(총 250μL) 플레이트를 표준 세포 배양 인큐베이터로 옮깁니다.
- 세포가 플레이트에 잘 부착되지 않는 경우, 세포가 단단히 부착될 때까지 1-5시간 더 기다린 다음(생물안전 캐비닛에서) 각 웰에 150µL의 성장 배지를 추가로 첨가하고(총 250µL) 플레이트를 표준 세포 배양 인큐베이터로 옮깁니다.
- 세포가 부착된 후 각 웰에 150μl의 성장 배지를 첨가하여 웰의 총 배지 부피를 250μl로 만듭니다. 웰에 배지를 첨가할 때 새로 부착된 세포를 방해하지 않도록 측면에 천천히 첨가합니다.
- 세포가 세포 배양 인큐베이터에서 밤새 성장하도록 합니다. 현미경을 사용하여 세포의 성장과 건강을 모니터링합니다.
2.4.2 XF HS miniplate
- 세포 분주 밀도 최적화 실험의 경우 위에 설명된 표준 또는 가속화된 워크플로를 기반으로 테스트할 2-4개의 세포 밀도를 선택합니다. 위의 참조에 있는 범위를 포괄하거나 권장 세포/웰 값(1X)과 웰당 0.5X, 2X 및 4X 세포를 분주합니다.
- 파란색 상자에서 miniplate 3팩을 꺼냅니다.
- 사용할 튜브에서 호일 씰을 제거합니다.
- 세포 배양 웰 주변의 moat에 멸균수 또는 PBS를 첨가합니다. 200μL로 설정된 8채널 피펫터를 사용하여 moat의 양쪽을 채웁니다(각 챔버에 2개의 팁이 들어갑니다). 멀티채널 피펫을 사용할 수 없는 경우, moat의 각 챔버에 400μL의 멸균수 또는 PBS를 채웁니다(총 3200μL).

(A) 8개의 챔버(녹색), 6개의 시료 웰(B-G, 분홍색) 및 백그라운드 웰(A, H, 회색)이 있는 moat를 보여주는 Seahorse XF HS miniplate의 다이어그램. (B) Seahorse XF HS miniplate 플레이트는 각 웰의 바닥에 "링" 구조를 갖추고 있어 세포를 더 작은 표면적으로 제한하여 더 작은 마이크로챔버 부피를 형성하므로 웰당 더 적은 수의 세포를 사용할 수 있습니다. (C) 링 구조와 세포 분주 영역(녹색 원)을 잘 보여주는 HS miniplate의 단면 보기.
- 웰 A와 H에 30μL 성장 배지(세포 없음)를 첨가합니다. 이는 백그라운드 보정 웰입니다.
- 세포를 채취하여 원하는 농도로 따뜻한 성장 배지에서 재부유합니다. 예시로 표를 보면, XF HS miniplate에 웰당 3.0 x 103 세포가 필요한 경우 웰당 3.0 x 103 세포/30µL 또는 1.0 x 105 세포/mL가 되는 양으로 세포를 재부유합니다.
| 플레이트 유형 | 최종 부착 세포 분주 부피 | 최종 분주 밀도(예시) | mL로 환산 |
|---|---|---|---|
| XF HS miniplates/ XF HS PDL miniplate |
30μL | 3.0×103 세포/30μL | 1.0×105 세포/mL |
- 각 웰의 내부 링 요소에 30μL의 세포 부유액을 분주합니다. XF HS miniplate에서 한 번에 하나의 웰에 세포를 분주하는 것을 권장합니다(세포 부유액을 적합하게 분주하려면 피펫 팁을 웰 바닥에 놓고 플런저를 단단하지만 일관되게 눌러야 합니다). 백그라운드 웰 A와 H에는 세포를 첨가하지 않습니다. 웰 바닥에 기포가 관찰되면 플레이트를 200 x g에서 1-2분 동안 원심분리하여 기포를 제거할 수 있습니다.
- 중요: 플레이트를 조직 배양 후드 내에서 실온 조건 하에 1시간 동안 안정되도록 둡니다.1 이는 균일한 세포 분포를 촉진하고 일부 세포 유형에 대한 엣지 효과를 줄일 수 있습니다. 현미경을 사용하여 부착성을 모니터링합니다.
- 세포가 세포 배양 인큐베이터에서 밤새 성장하도록 합니다. 현미경을 사용하여 세포의 성장과 건강을 모니터링합니다.
2.5 XFp PDL 또는 XF HS PDL miniplate 준비(부유 세포만 해당)
XF 기술을 사용하여 비부착 세포(예: T 세포, 백혈병 세포주 등)를 분석하려면 세포를 웰 바닥에 고정해야 합니다. 이는 각 웰의 바닥을 폴리 poly D-lysine(PDL)으로 코팅함으로써 가능해졌습니다. 애질런트는 즉시 사용 가능한 PDL 코팅 XFp 및 XF HS miniplate를 제공합니다. 이는 검증되었으며 T 세포와 함께 사용하는 것을 권장합니다. 바로 사용할 수 있는 PDL 플레이트를 37°C non-CO2 인큐베이터에서 하룻밤 동안 예열한 후 세포 분주에 사용합니다(최소 6시간).
XF 어세이 전날
XFp PDL 또는 HS PDL miniplate 준비
- XFp PDL 또는 XF HS PDL miniplate를 가져오고 사용할 플레이트에서 호일 씰을 제거합니다.
- 비습식 non-CO\2 37°C 인큐베이터에 플레이트를 하룻밤 동안 놓아둡니다.
참고: XFp PDL 및 XF PDL HS miniplate는 Agilent XFp Miniplate 캐리어 트레이(부품 번호 103057-100)와 호환됩니다.
부유 세포 분주는 일반적으로 XF 어세이 당일에 수행됩니다. 부유 세포 분주에 대한 지침은 섹션 3.2에서 확인하세요.
관련 지원 자료
- Agilent Seahorse XF96 세포 배양 마이크로플레이트에 부착 세포 분주
- Agilent Seahorse XF24 세포 배양 마이크로플레이트에 부착 세포 분주
- Agilent Seahorse XFp 세포 배양 miniplate에 부착 세포 분주
- Agilent Seahorse XF HS miniplate에 부착 세포 분주
- Agilent Seahorse XF 세포 배양 마이크로플레이트에서 세포 성장 엣지 효과를 감소시키는 분석법
- Agilent Seahorse XFe/XF96 또는 XFp 분석기에서의 어세이를 위해 Cell-Tak을 사용한 비부착 세포의 고정
- Agilent Seahorse XF HS miniplate에 부유 세포 분주
- Agilent Seahorse XFe/XF24 분석기 어세이를 위해 Cell-Tak을 사용한 비부착 세포의 고정
- 세포 특성 규명: XFe96/XF96 분석기 및 Seahorse XF Real-Time ATP 생성률 어세이
- 세포 특성 규명: XF24 분석기 및 세포 에너지 표현형 테스트
- 세포 특성 규명: XFp 분석기 및 Seahorse XFp Real-Time ATP 생성률 어세이
- 세포 특성 규명: XF HS Mini 분석기 및 XF Real-Time ATP 생성률 어세이
- 세포 특성 규명: HS miniplate와 XF Real-Time ATP 생성률 어세이를 갖춘 XF HS Mini 분석기
참고 자료
- Agilent Seahorse 어세이 가이드 및 템플릿
- Agilent Seahorse 어세이 가이드 및 템플릿
- Agilent Seahorse 어세이 가이드 및 템플릿
- Agilent Seahorse 어세이 가이드 및 템플릿
- Agilent Seahorse 어세이 가이드 및 템플릿
- Agilent Seahorse 템플릿
- 애질런트 세포 분석 발행물 데이터베이스
Agilent Cell Analysis 데이터를 사용하여 발행물의 전체 목록을 살펴보세요.

Seahorse에 대한 정보만 표시
기기 유형 변경3. XF 어세이 설정
이 섹션에서는 어세이 배지 준비를 포함하여 XFp 어세이 당일에 수행되는 기술에 중점을 둡니다. 비부착 세포 분주 및 주입용 용액으로 XFp 센서 카트리지 포트에 로딩.
도움말 콘텐츠를 표시하려면 워크플로 단계를 선택하세요.
3.1 카트리지 및 어세이 배지 준비
카트리지 준비
- 캘리브레이션 용액의 코니칼 튜브와 유틸리티 플레이트가 포함된 조립된 센서 카트리지를 인큐베이터에서 제거합니다.
- 센서 카트리지를 뒤집어 유틸리티 플레이트 옆에 놓습니다.
- 유틸리티 플레이트에서 물을 제거하고 버립니다.
- 유틸리티 플레이트의 각 웰을 미리 예열된 XF 캘리브레이션 용액 200μL로 채웁니다.
- 챔버당 400μL의 XF 캘리브레이션 용액으로 웰 외부 주변의 moat를 채웁니다.
- 센서 카트리지를 유틸리티 플레이트 위로 내리고 센서를 캘리브레이션 용액에 담급니다.
- 센서 카트리지의 주입 포트를 로드하기 전에 조립된 센서 카트리지를 유틸리티 플레이트와 함께 non-CO2 37°C 인큐베이터에 45-60분 동안 놓아둡니다.
- 하이드로부스터 및 유틸리티 플레이트와 함께 조립된 센서 카트리지를 인큐베이터에서 꺼냅니다.
- 센서 카트리지를 뒤집어 유틸리티 플레이트 옆에 놓습니다.
- 하이드로부스터를 제거하고 버립니다.
- 센서 카트리지를 유틸리티 플레이트 위로 내리고 센서를 캘리브레이션 용액에 담급니다.
- 조립된 센서 카트리지를 유티리티 플레이트와 함께 non-CO2 37°C 인큐베이터에 센서 카트리지의 주입 포트에 주입할 때까지 다시 넣습니다.
조립된 센서 카트리지와 유틸리티 플레이트를 non-CO2 37°C 인큐베이터에서 센서 카트리지의 주입 포트에 주입할 때까지 인큐베이션합니다.
XF 어세이 배지 준비
Seahorse 어세이는 대사 활동의 정확하고 일관된 기능적 측정을 위해 특정 배지가 필요합니다.
애질런트는 즉시 사용 가능한 저완충 배지를 제공하며, pH 7.4로 사전 조정되어 호환 가능한 보조제를 사용하면 어세이 준비를 간소화하고 일관된 어세이 조건을 제공할 수 있습니다. 이 즉시 사용 가능한 XF 어세이 배지 시스템에 대한 주문 정보를 보거나 배지 선택 가이드를 다운로드하세요.
또는 연구자는 사용 중인 어세이 키트와 일치하는 구성으로 배지를 제조할 수 있습니다. 모든 조성물은 특정 어세이 설계에 따라 결정된 대로 다른 기질/완충액을 첨가하여 Agilent Seahorse XF 배지 중 하나를 사용하여 준비할 수 있으며, 아래 예는 Seahorse XF Real-Time ATP 생성률 어세이 세포 에너지 표현형 테스트입니다.
Seahorse XF Real-Time ATP Rate Assay 키트와 함께 사용할 다음 XF 어세이 배지를 준비합니다.
연구자는 사용 중인 어세이 키트와 일치하는 구성으로 XF 어세이 배지를 제조해야 합니다. 모든 조성물은 특정 어세이 설계에 따라 결정된 대로 다른 기질/완충액을 첨가하여 Agilent Seahorse XF 배지 중 하나를 사용하여 준비할 수 있으며, 아래 예는 Seahorse XF Real-Time ATP Rate Assay 키트 세포 에너지 표현형 테스트입니다.
세포 에너지 표현형 테스트에 사용할 다음 XF 어세이 배지를 준비합니다.
| 애질런트 시약/애질런트 부품 번호 | 최종 농도 | 부피 | |||
|---|---|---|---|---|---|
| Seahorse XF DMEM 배지, pH 7.4a, b/103575-100 또는 Seahorse XF RPMI 배지, pH 7.4a, b/103576-100 |
XF Base 배지(w/out Phenol Red)a, b/103335-100 또는 XF RPMI (w/out Phenol Red)a, b/103336-100 |
Seahorse XF DMEM 배지a,b/103575-100 또는 Seahorse XF RPMI 배지a,b/103576-100 | - | 97.0mL | 9.70mL |
| Seahorse XF Glucose(1.0M 용액)/103577-100 | 10mM | 10μL | 10mM | 1.0mL | 100μL |
| Seahorse XF Pyruvate(100mM 용액)/103578-100 | 1mM | 1.0mL | 100μL | ||
| Seahorse XF L-Glutamine(200mM 용액)/103579-100 | 2mM | 1.0mL | 100μL | ||
| a XF DMEM 및 RPMI 배지, pH 7.4는 사전 조정된 pH 값을 가지며 XF 보조제를 첨가할 때 pH를 조정할 필요가 없습니다. 준비와 관련된 사항은 아래 분석법을 참조하세요. Seahorse XF DMEM 배지 pH 7.4 및 RPMI 배지, pH 7.4는 XF24 분석기와 호환되지 않습니다. b 다른 유형의 XF 배지를 사용한 준비 다른 유형의 XF 배지를 사용한 준비 다른 유형의 XF 배지를 사용한 준비 다른 유형의 XF 배지를 사용한 준비 다른 유형의 XF 배지를 사용한 준비. |
|||||
XF DMEM 배지 pH 7.4 또는 XF RPMI 배지 pH 7.4를 준비하기 위한 기본 절차
XF Base 배지(w/o Phenol Red) 또는 XF RPMI(w/o Phenol Red) 준비를 위한 기본 절차
필요한 장비:
- 37°C 수조
- 검량된 pH 측정기
- 교반 플레이트
- 멸균 필터병(0.22μm 필터) 및 캡
- 1.0N NaOH 용액
Agilent Seahorse XF DMEM 배지 pH 7.4 및 XF RPMI 배지 pH 7.4는 다음과 같은 이점을 제공하도록 설계되었습니다.
- 편의성: Agilent Seahorse XF 보조제와 함께 권장되는 대로 사용하는 경우 최종 pH 조정이 필요하지 않습니다.
- 일관성: 낮은 농도의 HEPES 완충액(5mM, DMEM, 1mM, RPMI)은 보다 일관된 XF 데이터를 제공합니다.
- 정량: 고정된 완충액 용량을 갖춘 어세이 배지를 사용하면 양성자 유출율(PER)을 정량적으로 측정할 수 있습니다.
- 적합한 양의 XF DMEM 배지 pH7.4 또는 XF RPMI 배지 pH 7.4를 멸균병에 넣어 37°C로 따뜻하게 합니다. 일반적으로 플레이트 1개에는 100mL이면 충분합니다.
- 적합한 양의 XF Base 배지(w/o Phenol Red) 또는 XF RPMI(w/o Phenol Red)를 멸균병에 넣어 37°C로 따뜻하게 합니다. 일반적으로 XF24 플레이트 1개에는 100mL이면 충분합니다.
- 위 표에 표시된 적합한 양의 Seahorse XF 보조제(XF Glucose 용액, XF Pyruvate 용액 및 XF L-Glutamine 용액)를 첨가합니다.
- 1N NaOH를 사용하여 배지의 pH 값을 7.4로 조정합니다. 참고: NaOH를 첨가하면 pH 값이 빠르게 변합니다. 소량을 사용하고 천천히 첨가하여 pH 값을 조정합니다.
- 0.2μm 필터로 어세이 배지를 멸균합니다.
- 사용할 준비가 될 때까지 최종 XF 어세이 배지를 37°C에서 배양합니다.
관련 지원 자료
- 교육 웨비나: XF어세이 설정 및 실행
- Agilent Seahorse XFe96 센서 카트리지 수화 방법
- Agilent Seahorse XFe24 센서 카트리지 수화 방법
- Agilent Seahorse XF24 센서 카트리지 수화 방법
- Agilent Seahorse XFp 센서 카트리지 수화 방법
- XF 어세이 배지 준비
- 세포 특성 규명: XFe96/XF96 분석기 및 Seahorse XF Real-Time ATP 생성률 어세이
- 세포 특성 규명: XFp 분석기 및 Seahorse XFp Real-Time ATP 생성률 어세이
- 세포 특성 규명: XF HS Mini 분석기 및 XF Real-Time ATP 생성률 어세이
- 세포 특성 규명: HS miniplate와 XF Real-Time ATP 생성률 어세이를 갖춘 XF HS Mini 분석기
- 세포 특성 규명: XF24 분석기 및 Seahorse XF Real-Time ATP 생성률 어세이
- 세포 특성 규명: XFe24 분석기 및 Seahorse XF Real-Time ATP 생성률 어세이
참고 자료
- Agilent Seahorse 어세이 가이드 및 템플릿
- Agilent Seahorse 어세이 가이드 및 템플릿
- Agilent Seahorse 어세이 가이드 및 템플릿
- Agilent Seahorse 어세이 가이드 및 템플릿
- Agilent Seahorse 어세이 가이드 및 템플릿
- Agilent Seahorse 템플릿
- 애질런트 세포 분석 발행물 데이터베이스
Agilent Cell Analysis 데이터를 사용하여 발행물의 전체 목록을 살펴보세요.
3.2 세포 세척
XFp miniplate에 분주된 부착 세포를 세척하는 기본 절차
참고: XF HS miniplate 또는 XF HS PDL miniplate의 부착 세포를 세척하려면 아래 관련 지원 자료에 있는 지침을 따르세요.
XFp HS Mini 어세이 최소 하루 전에 분주한 부착 세포의 경우:
- CO2 인큐베이터에서 세포 배양 miniplate를 가져옵니다.
- 현미경으로 세포를 관찰하여 다음을 수행합니다.
- 세포 건강, 형태, 분주 균일성 및 순도(오염 없음)를 확인합니다.
- 일관된 단층으로 세포가 부착되었는지 확인합니다.
- 백그라운드 보정 웰에 세포가 없는지 확인합니다.
- 부착 세포를 완전한 어세이 배지로 세척하세요. XF Real-Time ATP 생성률 어세이 배지로 한 번 세척하세요.
- 각 웰에서 배양 배지의 20μL을 제외한 모든 것을 제거합니다. 세포가 건조되는 것을 방지하기 위해 소량의 배지를 남깁니다.
- 200μL의 어세이 배지를 부드럽게 첨가합니다.
- 어세이 전 1시간 동안 CO2가 없는 37°C 인큐베이터에 플레이트를 1시간 동안 놓아둡니다.
- 각 웰에서 배양 배지의 50μL을 제외한 모든 것을 제거합니다. 세포가 건조되는 것을 방지하기 위해 소량의 배지를 남깁니다.
- 어세이 배지 1mL를 부드럽게 첨가합니다.
- 어세이 전 1시간 동안 CO2가 없는 37°C 인큐베이터에 플레이트를 1시간 동안 놓아둡니다.
- b 단계를 반복하여 50μL만 남기고 모두 제거합니다(a 단계와 동일).
- 24 웰 플랫폼 기기에 450μL 어세이 배지(총 부피 500μL)를 첨가합니다.
- 어세이를 시작하기 직전에 XF Real-Time ATP 생성률 어세이 배지로 세포를 다시 세척합니다. 50μL를 제외한 모든 배지를 제거하고 최종 부피 500μL에 새로운 배지를 첨가합니다. 현미경으로 세포를 검사하여 세포가 손상되거나 씻겨 나가지 않았는지 확인합니다.
- 어세이를 시작하기 직전에 XF Real-Time ATP 생성률 어세이 배지로 세포를 다시 세척합니다. 20μL를 제외한 모든 배지를 제거하고 최종 부피 180μL에 새로운 배지를 첨가합니다. 현미경으로 세포를 검사하여 세포가 손상되거나 씻겨 나가지 않았는지 확인합니다.
- 세포가 씻겨 나가지 않았는지 확인하기 위해 현미경으로 어세이 웰을 관찰합니다.
- 어세이 전 1시간 동안 CO2가 없는 37°C 인큐베이터에 플레이트를 1시간 동안 놓아둡니다.
3.2 부유 세포 분주
XF HS PDL miniplate 및 XFp PDL miniplate에 부유 세포를 분주하는 기본 절차
참고: XF HS PDL miniplate의 부유 세포 분주에 대한 추가 정보를 보려면 아래 관련 지원 자료에 있는 지침을 따르세요.
부유 세포의 최적 세포 밀도는 세포 크기에 따라 다릅니다. 일반적으로 최적의 세포 분주 밀도는 웰에 세포가 70-90%의 합류 지점에서 단층으로 분포하는 것입니다. 현미경으로 세포 분포를 검사하여 (1) 모든 세포가 코팅 표면에 고르게 접촉할 수 있도록 세포 사이에 적합한 공간이 있는지, (2) 세포 클러스터가 최소화되었는지 확인할 것을 강력히 권장합니다. 최적의 밀도 이상으로 과도한 수의 세포를 분주하거나 세포가 서로 클러스팅되면 세포 접착력이 떨어지고 속도 측정이 부정확해질 수 있습니다.


- 세포 배양 마이크로플레이트는 성장 용기에서 코니칼 튜브로 적합한 양의 세포 부유액을 옮깁니다.
- 하나의 XFp miniplate, XF HS miniplate 또는 XF HS PDL miniplate의 경우 성장 용기에서 코니칼 튜브로 적합한 양의 세포 부유액을 옮깁니다.
- 필요한 총 세포 수를 계산하려면 웰당 원하는 세포 수에 Seahorse XFe96의 웰 100개를 곱합니다. (예를 들어 웰당 150,000개 세포 × 100개 웰 = 1.5 × 107 세포).
- 필요한 총 세포 수를 계산하려면 웰당 원하는 세포 수에 Seahorse의 웰 10개를 곱합니다. (예를 들어 웰당 150,000개 세포 × 10개 웰 = 1.5 × 106 세포).
- 실온에서 200 x g으로 5분간 세포를 원심분리합니다.
- 세포가 원심분리되는 동안 피펫 50μL 어세이 배지를 예열된 PDL 코팅 Seahorse XF96 세포 배양 마이크로플레이트 또는 Cell-Tak 코팅 Seahorse XF96 세포 배양 플레이트의 백그라운드/대조 웰에 피펫팅합니다.
- 세포가 원심분리되는 동안 피펫 50μL 어세이 배지를 예열된 PDL 코팅 Seahorse XFp 세포 배양 마이크로플레이트 또는 Cell-Tak 코팅 Seahorse XFp 세포 배양 플레이트의 백그라운드/보정 웰(A 또는 H)에 피펫팅합니다.
- 원심분리된 코니칼 튜브에서 상등액을 제거합니다.
- 50μL의 어세이 배지에 웰당 원하는 세포 농도로 따뜻해진 어세이 배지에 세포를 재부유합니다.(예를 들어 웰당 1.5×105 세포가 필요한 경우, 1.5×105 세포/50μL 또는 3.0×106 세포/mL가 되는 부피로 세포를 재부유합니다.)
- 원심분리기 설정을 브레이크 제로로 변경합니다.
- 세포 부유액을 멸균 조직 배양 저장소로 옮기거나 코니칼 튜브에서 피펫팅합니다.
- 백그라운드/대조 웰을 제외하고 각 웰의 측면을 따라 세포 부유액의 50μL을 피펫합니다. 멀티채널 피펫을 사용하는 것을 권장합니다.
- miniplate를 XFp 캐리어 트레이에 놓고 브레이크 없이 1분 동안 300 x g로 원심분리합니다. 캐리어는 최대 3개의 miniplate를 수용하고 표준 원심분리 마이크로플레이트 어댑터에 적합하도록 설계되었습니다. 원심분리기 로터의 균형이 적합하게 잡혀 있는지 확인합니다.
- 원심분리 후 세포가 웰 바닥에 부착되었는지 시작적으로 확인합니다.
- 200 × g(브레이크 제로)에서 1분간 세포를 원심분리합니다. 원심분리기의 균형이 적합하게 잡혀 있는지 확인합니다.
- 바닥에 있는 세포를 손상시키지 않도록 주의하면서 각 웰에 130μL 어세이 배지를 원하는 초기 어세이 부피(180μL 시작 어세이 부피의 경우)까지 부드럽게 첨가합니다.
- 세포 배양 웰 주변의 moat에 멸균수 또는 PBS를 챔버당 100μL 첨가합니다. 50μL로 설정된 8채널 피펫터(사용 가능한 경우)를 사용하여 챔버당 2개의 팁을 사용하여 moat의 양쪽을 채웁니다. 멀티채널 피펫을 사용할 수 없는 경우 moat의 각 챔버에 100μL의 멸균수 또는 PBS를 개별적으로 채웁니다(총 800μL).
- 플레이트를 CO2가 보충되지 않은 37°C 인큐베이터로 옮겨 25-30분 동안 세포가 완전히 부착되었는지 확인합니다. 대부분의 세포가 배지 표면에 안정적으로 부착되었는지 시작적으로 확인합니다.
- 천천히 그리고 부드럽게 각 웰의 측면을 따라 따뜻한 어세이 배지 130μL를 첨가합니다. 세포를 손상시키지 않도록 주의하세요.
- 세포가 분리되지 않았는지 확인하기 위해 현미경으로 세포를 관찰합니다.
- 세포 플레이트를 인큐베이터에 15-25분 동안 다시 넣습니다.
- 15-25분 후에 세포 플레이트가 어세이 준비가 완료됩니다. 최상의 결과를 얻으려면 원심분리 후 총 시간이 1시간을 넘지 않아야 합니다.
- Seahorse XF24 세포 배양 마이크로플레이트 1개의 경우 적합한 양의 세포 부유액을 성장 용기에서 코니칼 튜브로 옮깁니다.
- 필요한 총 세포 수를 계산하려면 웰당 원하는 세포 수에 Seahorse XF24의 웰 25개를 곱합니다. (예를 들어 웰당 150,000개 세포 × 25개 웰 = 3.75 × 106 세포).
- 실온에서 200 x g으로 5분간 세포를 원심분리합니다.
- 세포가 원심분리되는 동안 피펫 100μL 어세이 배지를 실온 Cell-Tak 코팅 Seahorse XF24 세포 배양 플레이트의 백그라운드/대조 웰에 피펫팅합니다.
- 원심분리된 코니칼 튜브에서 상등액을 제거합니다.
- 100μL의 어세이 배지에 웰당 원하는 세포 농도로 따뜻해진 어세이 배지에 세포를 재부유합니다.(예를 들어 웰당 1.5×105 세포가 필요한 경우, 1.5×105 세포/100μL 또는 1.5×106 세포/mL가 되는 부피로 세포를 재부유합니다.)
- 원심분리기 설정을 브레이크 제로로 변경합니다.
- 세포 부유액을 멸균 조직 배양 저장소로 옮기거나 코니칼 튜브에서 피펫팅합니다.
- 백그라운드/대조 웰을 제외하고 각 웰의 측면을 따라 세포 부유액의 100μL을 피펫팅합니다. 애질런트는 멀티채널 피펫 사용을 권장합니다.
- 200 × g(브레이크 제로)에서 1분간 세포를 원심분리합니다. 원심분리기의 균형이 적합하게 잡혀 있는지 확인합니다. XFp 분석기 사용자의 경우, 애질런트는 Agilent Seahorse XFp 캐리어 트레이를 사용하여 Seahorse XFp 세포 배양 Miniplate를 원심분리할 것을 권장합니다. 자세한 내용은 기본 절차 "XFp 세포 배양 miniplate에 부유 세포 분주"를 참조하세요.
- 플레이트를 CO2가 보충되지 않은 37°C 인큐베이터로 옮겨 25-30분 동안 세포가 완전히 부착되었는지 확인합니다. 대부분의 세포가 배지 표면에 안정적으로 부착되었는지 시작적으로 확인합니다.
- 천천히 그리고 부드럽게 각 웰의 측면을 따라 따뜻한 어세이 배지 400μL를 첨가합니다. 세포를 손상시키지 않도록 주의하세요.
- 세포가 분리되지 않았는지 확인하기 위해 현미경으로 세포를 관찰합니다.
- 세포 플레이트를 인큐베이터에 15-25분 동안 다시 넣습니다.
- 15-25분 후에 세포 플레이트가 어세이 준비가 완료됩니다. 최상의 결과를 얻으려면 원심분리 후 총 시간이 1시간을 넘지 않아야 합니다.
XFp PDL 또는 XF HS PDL miniplate에 부유 세포을 분주하는 데 필요한 단계 개요.
관련 지원 자료
- Agilent Seahorse XFp 세포 배양 miniplate에서 부착 세포 세척
- Agilent Seahorse XF96 세포 배양 마이크로플레이트에서 부착 세포 세척
- Agilent Seahorse XF24 세포 배양 마이크로플레이트에서 부착 세포 세척
- Agilent Seahorse XF96 세포 배양 마이크로플레이트에서 부착 세포 세척
- Agilent Seahorse XF24 세포 배양 마이크로플레이트에서 부착 세포 세척
- Agilent Seahorse XFe96/XF96 또는 XFp 분석기에서의 어세이를 위해 Cell-Tak을 사용한 비부착 세포의 고정
- Agilent Seahorse XFe24/XF24 분석기에서의 어세이를 위해 Cell-Tak을 사용한 비부착 세포의 고정
- Agilent Seahorse XF HS miniplate에 부유 세포 분주
- Agilent Seahorse XFp 세포 배양 miniplate에 부유 세포 분주
- 세포 특성 규명: XFe96/XF96 분석기 및 Seahorse XF Real-Time ATP 생성률 어세이
- 세포 특성 규명: XF24 분석기 및 세포 에너지 표현형 테스트
- 세포 특성 규명: XFe24 분석기 및 Seahorse XF Real-Time ATP 생성률 어세이
- 세포 특성 규명: XFp 분석기 및 Seahorse XF Real-Time ATP 생성률 어세이
- 세포 특성 규명: XF HS Mini 분석기 및 XF Real-Time ATP 생성률 어세이
- 세포 특성 규명: HS miniplate와 XF Real-Time ATP 생성률 어세이를 갖춘 XF HS Mini 분석기
참고 자료
- Agilent Seahorse 어세이 가이드 및 템플릿
- Agilent Seahorse 어세이 가이드 및 템플릿
- Agilent Seahorse 어세이 가이드 및 템플릿
- Agilent Seahorse 어세이 가이드 및 템플릿
- Agilent Seahorse 어세이 가이드 및 템플릿
- Agilent Seahorse 템플릿
- 애질런트 세포 분석 발행물 데이터베이스
Agilent Cell Analysis 데이터를 사용하여 발행물의 전체 목록을 살펴보세요.
3.2.1 XFp PDL miniplate
- 비습식, non-CO2 37°C 인큐베이터에서 XFp PDL miniplate를 꺼냅니다.
- 세포 배양 웰 주변의 moat에 멸균수 또는 PBS를 챔버당 400μL 첨가합니다. 200μL로 설정된 8채널 피펫터(사용 가능한 경우)를 사용하여 챔버당 2개의 팁을 사용하여 moat의 양쪽을 채웁니다. 멀티채널 피펫을 사용할 수 없는 경우 moat의 각 챔버에 400μL의 멸균수 또는 PBS를 개별적으로 채웁니다(총 3200μL).
- 원하는 분주 농도를 결정합니다. 부유 세포에 대한 최적의 세포 밀도는 세포 크기에 따라 다릅니다. XFp PDL miniplate의 경우 분주 수는 일반적으로 5 × 104-2 × 105 세포/웰 사이입니다.
- 웰당 원하는 세포 수에 각 miniplate에 대한 10개의 웰을 곱하여 필요한 총 세포 수를 계산합니다. (예를 들어 웰당 150,000개 세포 × 10개 웰 = 1.5 × 106 세포). 그런 다음 성장 용기에서 코니칼 튜브로 적합한 양의 세포 부유액을 옮깁니다.
- 실온에서 200 x g으로 5분간 세포를 원심분리합니다. 그런 다음 원심분리된 코니칼 튜브에서 상등액을 제거하고 따뜻한 어세이 배지에 세포를 원하는 농도로 재부유합니다. 예를 들어 웰당 1.5 x 105 세포가 필요한 경우 웰당 1.5 x 105 세포/50µL 또는 1.0 x 106세포/mL가 되는 양으로 세포를 재부유합니다.
- 백그라운드 웰(A 및 H)에 50μL 어세이 배지를 피펫팅합니다.
- 원심분리기 설정을 브레이크 제로로 변경합니다.
- 세포 부유액을 멸균 조직 배양 저장소로 옮기거나 코니칼 튜브에서 피펫팅합니다.
- 백그라운드/대조 웰(A 및 H)을 제외하고 각 웰의 측면을 따라 세포 부유액의 50μL을 피펫합니다. 멀티채널 피펫을 사용하는 것을 권장합니다.
- 플레이트에 세포나 배지를 첨가하면 웰 바닥에 기포가 형성될 수 있습니다. 이러한 기포는 원심분리 시 제거될 가능성이 높습니다.
- XFp 캐리어 트레이에 miniplate를 놓고 세포가 웰 바닥에 부착될 수 있도록 200 x g로 1분 동안 원심분리합니다. 캐리어는 최대 3개의 miniplate를 수용하고 표준 원심분리 마이크로플레이트 어댑터에 적합하도록 설계되었습니다. 원심분리기 로터의 균형이 적합하게 잡혀 있는지 확인합니다.
- 원심분리 후 세포가 웰 바닥에 부착되었는지 시작적으로 확인합니다.
- 각 웰에 130μL 어세이 배지를 원하는 초기 어세이 부피(180μL 시작 어세이 부피의 경우)까지 부드럽게 첨가합니다.
- 사용하기 전에 플레이트를 37°C, non-CO2 인큐베이터로 45-60분간 옮깁니다. 대부분의 세포가 배양 표면에 안정적으로 부착되었는지 시작적으로 확인합니다.
- 최상의 결과를 얻으려면 원심분리 후 총 시간이 1시간을 넘지 않아야 합니다.
- 섹션 3.4로 이동하기
3.2.2 XF HS PDL miniplate
- 비습식, non-CO2 37°C 인큐베이터에서 XF HS PDL miniplate를 꺼냅니다.
- 세포 배양 웰 주변의 moat에 멸균수 또는 PBS를 챔버당 400μL 첨가합니다. 200μL로 설정된 8채널 피펫터(사용 가능한 경우)를 사용하여 챔버당 2개의 팁을 사용하여 moat의 양쪽을 채웁니다. 멀티채널 피펫을 사용할 수 없는 경우 moat의 각 챔버에 400μL의 멸균수 또는 PBS를 개별적으로 채웁니다(총 3200μL).
- 원하는 분주 농도를 결정합니다. 부유 세포에 대한 최적의 세포 밀도는 세포 크기에 따라 다릅니다 XF HS PDL miniplate의 경우 분주 수는 일반적으로 2.0 × 104에서 7.0 × 104 세포/웰 사이입니다.
- 웰당 원하는 세포 수에 각 miniplate에 대한 10개의 웰을 곱하여 필요한 총 세포 수를 계산합니다. (예를 들어 웰당 150,000개 세포 × 10개 웰 = 1.5 × 106 세포). 그런 다음 성장 용기에서 코니칼 튜브로 적합한 양의 세포 부유액을 옮깁니다.
- 실온에서 200 x g으로 5분간 세포를 원심분리합니다. 그런 다음 원심분리된 코니칼 튜브에서 상등액을 제거하고 따뜻한 어세이 배지에 세포를 원하는 농도로 재부유합니다. 예를 들어 웰당 3 x 104 세포가 필요한 경우 웰당 3 x 104 세포/30µL 또는 1.0 x 106 세포/mL가 되는 양으로 세포를 재부유합니다.
- 백그라운드 웰(A 및 H)에 30μL 어세이 배지를 피펫팅합니다.
- 원심분리기 설정을 브레이크 제로로 변경합니다.
- 세포 부유액을 멸균 조직 배양 저장소로 옮기거나 코니칼 튜브에서 피펫팅합니다.
- 각 웰의 내부 링 요소에 세포 부유액 30μL을 피펫팅합니다. 200μL(또는 더 작은) 피펫 팁을 사용하여 한 번에 하나의 웰에 세포를 분주하는 것을 권장합니다. 피펫 팁을 웰 바닥에 놓아야 제대로 분주할 수 있습니다. 백그라운드 웰 A와 H에 세포를 첨가하지 않습니다.
- 플레이트에 세포나 배지를 첨가하면 웰 바닥에 기포가 형성될 수 있습니다. 이러한 기포는 원심분리 시 제거될 가능성이 높습니다.
- XFp 캐리어 트레이에 miniplate를 놓고 세포가 웰 바닥에 부착될 수 있도록 200 x g로 1분 동안 원심분리합니다. 캐리어는 최대 3개의 miniplate를 수용하고 표준 원심분리 마이크로플레이트 어댑터에 적합하도록 설계되었습니다. 원심분리기 로터의 균형이 적합하게 잡혀 있는지 확인합니다.
- 원심분리 후 세포가 웰 바닥에 부착되었는지 시작적으로 확인합니다.
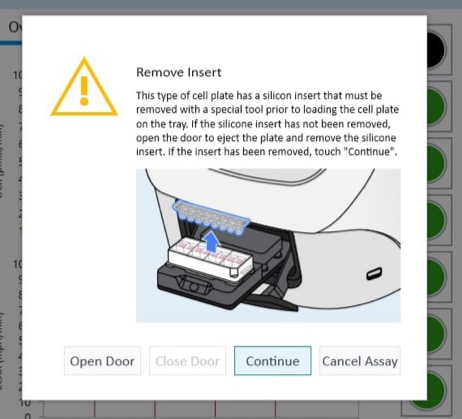
- 다음과 같이 마스크 제거 도구를 사용하여 실리콘 마스크를 조심스럽게 제거합니다.
- 한 손으로 플레이트를 벤치나 작업 표면 위에 평평하게 잡습니다. 다른 손으로 플레이트 상단과 마스크 사이에 도구를 삽입합니다.
- 제거 도구의 프롱은 삽입되는 동안 플레이트의 상단 표면과 평행을 유지해야 합니다.
- 도구를 더 삽입하기 위해 앞뒤로 레버를 움직이지 마세요. 레버를 앝뒤로 움직이면 흡입력이 발생하고 잠재적으로 세포층이 손상될 수 있습니다.
- 목표는 동시에 모든 웰에서 한 번의 움직임으로 마스크를 제거하는 것입니다.
- 도구가 완전히 삽입되면 이를 레버로 사용하여 마스크를 제거합니다.
- 마스크는 프롱에 남아있지 않습니다. 마스크가 플레이트에서 분리되기 시작하면 손가락을 사용하여 도구에 고정하여 플레이트에 떨어지지 않도록 합니다.
- 제거한 후 플레이트 마스크를 폐기합니다.
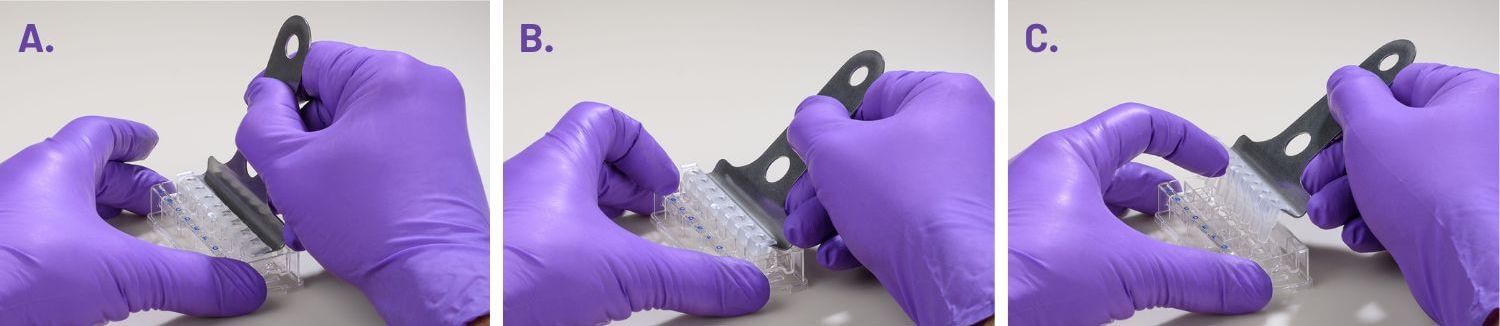
(A) 도구 바닥을 플레이트 상단과 평행하게 유지하면서 각 웰 사이에 제거 도구의 프롱을 삽입합니다.
(B) 프롱이 삽입되면 플레이트의 웰에서 마스크를 레버로 꺼냅니다.
(C) 마스크가 떨어지는 것을 방지하기 위해 플레이트에서 들어올릴 때 한 손가락으로 제거 도구 위에 마스크를 잡습니다.
참고: 실리콘 마스크를 제거하면 배지도 제거될 수 있습니다. 각 웰에는 약 20μL의 배지가 남습니다. 일관되지 않은 부피가 남아 있는 경우 링 내의 세포에 닿지 않도록 주의하면서 웰의 외부 링 영역에서만 배지를 조심스럽게 제거합니다. 항상 세포를 덮을 수 있는 일부 배지를 남겨둡니다. 각 웰의 전체 부피의 작은 차이는 OCR 또는 ECAR에 영향을 미치지 않지만 주입된 시약의 최종 농도는 영향을 받을 수 있습니다.
- 각 웰에 160μL 어세이 배지를 원하는 초기 어세이 부피(180μL 시작 어세이 부피의 경우)까지 부드럽게 첨가합니다.
- 사용하기 전에 플레이트를 37°C non-CO2 인큐베이터로 45-60분간 옮깁니다. 대부분의 세포가 배양 표면에 안정적으로 부착되었는지 시작적으로 확인합니다.
- 최상의 결과를 얻으려면 원심분리 후 총 시간이 1시간을 넘지 않아야 합니다.
- 섹션 3.4로 이동하기
3.3 부착 세포 세척의 기본 절차
3.3.1 XFp miniplate의 부착 세포 세척
XF HS Mini 어세이 최소 하루 전에 분주한 부착 세포의 경우:
- CO2 인큐베이터에서 세포 배양 miniplate를 가져옵니다.
- 현미경으로 세포를 관찰하여 다음을 수행합니다.
- 세포 건강, 형태, 분주 균일성 및 순도(오염 없음)를 확인합니다.
- 일관된 단층으로 세포가 부착되어 있는지 확인합니다.
- 백그라운드 보정 웰에 세포가 없는지 확인합니다.
- XF 어세이 배지로 세포를 세척합니다.
- 각 웰에서 배양 배지의 20μL을 제외한 모든 것을 제거합니다. 세포가 건조되는 것을 방지하기 위해 소량의 배지를 남깁니다.
- 200μL의 어세이 배지를 부드럽게 첨가합니다.
- 어세이 전 1시간 동안 CO2가 없는 37°C 인큐베이터에 플레이트를 1시간 동안 놓아둡니다.
- 어세이를 시작하기 직전에 XF Real-Time ATP 생성률 어세이 배지로 세포를 다시 세척합니다. 20μL를 제외한 모든 배지를 제거하고 최종 부피 180μL에 새로운 배지를 첨가합니다. 현미경으로 세포를 검사하여 세포가 손상되거나 씻겨 나가지 않았는지 확인합니다.
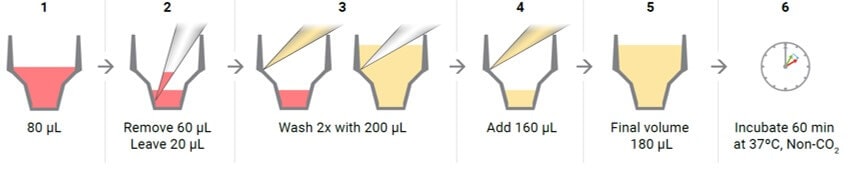
3.3.2 XF HS miniplate의 부착 세포 세척
XF HS Mini 어세이 최소 하루 전에 분주한 부착 세포의 경우:
- CO2 인큐베이터에서 세포 배양 miniplate를 가져옵니다.
- 현미경으로 세포를 관찰하여 다음을 수행합니다.
- 세포 건강, 형태, 분주 균일성 및 순도(오염 없음)를 확인합니다.
- 일관된 단층으로 세포가 부착되었는지 확인합니다.
- 백그라운드 보정 웰에 세포가 없는지 확인합니다.
- XF 분석 전에 마스크 제거 도구를 사용하여 실리콘 마스크를 제거합니다
- 한 손으로 플레이트를 벤치나 작업 표면 위에 평평하게 잡습니다. 그런 다음 다른 손으로 플레이트 상단과 마스크 사이에 도구를 삽입합니다.
- 제거 도구의 프롱은 삽입되는 동안 플레이트의 상단 표면과 평행을 유지해야 합니다.
- 도구를 더 삽입하기 위해 앞뒤로 레버를 움직이지 마세요. 레버를 앝뒤로 움직이면 흡입력이 발생하고 잠재적으로 세포층이 손상될 수 있습니다.
- 목표는 동시에 모든 웰에서 한 번의 움직임으로 마스크를 제거하는 것입니다.
- 도구가 완전히 삽입되면 이를 레버로 사용하여 마스크를 제거합니다.
- 마스크는 프롱에 남아있지 않습니다. 마스크가 플레이트에서 분리되기 시작하면 손가락을 사용하여 도구에 고정하여 플레이트에 떨어지지 않도록 합니다.
- 제거한 후 플레이트 마스크를 폐기합니다.

(A) 도구 바닥을 플레이트 상단과 평행하게 유지하면서 각 웰 사이에 제거 도구의 프롱을 삽입합니다.
(B) 프롱이 삽입되면 플레이트의 웰에서 마스크를 레버로 꺼냅니다.
(C) 마스크가 떨어지는 것을 방지하기 위해 플레이트에서 들어올릴 때 한 손가락으로 제거 도구 위에 마스크를 잡습니다.
참고: 실리콘 마스크를 제거하면 배지도 제거될 수 있습니다. 각 웰에는 약 20μL의 배지가 남습니다. 일관되지 않은 부피가 남아 있는 경우 링 내의 세포에 닿지 않도록 주의하면서 웰의 외부 링 영역에서만 배지를 조심스럽게 제거합니다. 항상 세포를 덮을 수 있는 일부 배지를 남겨둡니다. 각 웰의 전체 부피의 작은 차이는 OCR 또는 ECAR에 영향을 미치지 않지만 주입된 시약의 최종 농도는 영향을 받을 수 있습니다.
- XF 어세이 배지로 세포를 세척합니다.
- 200μL의 어세이 배지를 부드럽게 첨가한 다음 세척 과정을 반복하기 전에 각 웰에서 20μL의 어세이 배지를 제외한 모든 어세이 배지를 제거합니다.
- 마지막으로 어세이 배지(약 160μL)를 첨가하여 시작 부피 180μL가 되도록 합니다.
- 세척 후 세포층을 관찰하여 세포가 손상되거나 씻겨 나가지 않았는지 확인합니다. 세척한 세포 플레이트를 어세이 수행 전 37°C non-CO2 인큐베이터에 60분간 둡니다.
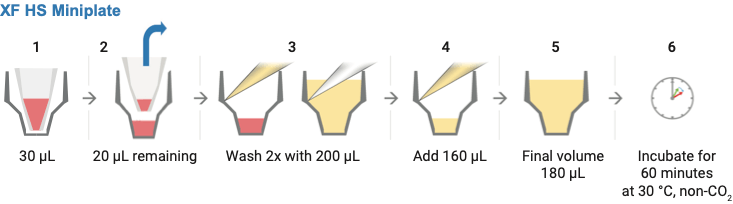
실리콘 마스크 2단계를 제거하고 XF 어세이 배지를 사용하여 XF HS miniplate에서 시료를 세척하는 데 필요한 단계를 표시하는 도식화된 그림
3.3 용액 조립
3.4 용액 조립
Agilent Seahorse 분석기의 주요 특징은 어세이 중에 시약을 주입하고 결과를 실시간으로 확인할 수 있다는 것입니다. 이는 기기에 배치하기 전에 카트리지 내의 주입기 포트에 로드된 용액을 분주함으로써 수행됩니다.
세포 에너지 표현형 어세이를 사용하여 세포 밀도 및/또는 FCCP 적정의 초기 세포 특성 규명 수행하는 경우 아래 표에 설명된 대로 주입 용액을 준비합니다.
Seahorse XFp Real-Time ATP 생성률 어세이를 사용하여 세포 밀도의 초기 세포 특성 규명을 수행하는 경우 아래 표에 설명된 대로 주입 용액을 준비합니다.
Seahorse XF Real-Time ATP 생성률 어세이를 사용하여 세포 밀도의 초기 세포 특성 규명을 수행하는 경우 아래 표에 설명된 대로 주입 용액을 준비합니다.
세포 밀도 적정 어세이 용액 조립
FCCP 농도 적정 어세이 용액 조립
- Seahorse XF Real-Time ATP Rate Assay 키트 상자에서 파우치 1개를 제거하고 두 튜브(Oligo 및 Rotenone + Antimycin A)를 모두 제거합니다.
- Seahorse XF 세포 에너지 표현형 테스트 키트 상자에서 파우치 1개를 제거하고 두 튜브(Oligo 및 FCCP)를 모두 제거합니다.
- 피펫을 사용하여 아래 표에 설명된 용량을 사용하여 준비된 어세이 배지로 각 튜브의 내용물을 재부유합니다. 튜브에 캡을 놓고 1분간 볼텍스 처리하여 화합물을 용해시킵니다.
| Seahorse XF Real-Time ATP Rate Assay 키트의 재부유 부피 | ||||
|---|---|---|---|---|
| 화합물 | XF 어세이 배지의 부피 | 최종 원액 농도 | ||
| Oligomycin | 420μl | 168µL | 150μM | 75µm |
| Rotenone + Antimycin A | 540µL | 216µL | 50µm | 25µm |
| XF 세포 에너지 표현형 테스트 키트의 재부유 부피 | ||
|---|---|---|
| XF 세포 에너지 표현형 테스트 구성요소 | XF 어세이 배지의 부피(μL) | 최종 원액 농도(μM) |
| Oligomycin | 630 | 100 |
| FCCP | 720 | 100 |
- 아래 표에 설명된 대로 적합한 양의 XF 어세이 배지와 원액 oligomycin 및 원액 rotenone/antimycin A를 결합하여 각 주입 용액 3.0mL를 준비합니다.
- 15mL 코니칼 튜브를 사용하여 아래 표에 설명된 대로 적합한 양의 XF 어세이 배지, 원액 oligomycin 및 원액 FCCP를 결합하여 3.0mL의 주입 용액을 준비합니다.
- 아래 표에 설명된 대로 적합한 양의 XF 어세이 배지와 원액 oligomycin 및 원액 rotenone/antimycin A를 결합하여 각 주입 용액 300µL를 준비합니다.
| XF Real-Time ATP Rate Assay 키트의 희석 부피 - 세포 특성 규명 | ||||||
|---|---|---|---|---|---|---|
| 포트 및 화합물 | 원액 부피 | XF 어세이 배지 부피 | 10X[포트] | [최종 웰] | ||
| 포트 A Oligomycin | 300µL | 60µL | 2700µL | 240µL | 15µm | 1.5µm |
| 포트 B Rotenone + Antimycin A | 300µL | 60µL | 2700µL | 240µL | 5µm | 0.5µm |
| XF 세포 에너지 표현형 테스트 키트의 희석 부피 - XFe24/XF24를 사용한 세포 분주 밀도 적정 | |||||
|---|---|---|---|---|---|
| 웰의 최종 FCCP 농도 | 어세이 배지의 부피(μL) | 원액 Oligomycin의 부피(μM) | 원액 FCCP의 부피(μL) | 10X 최종 Oligo(포트) 농도(μM) | 10X 최종 FCCP(포트) 농도(μM) |
| 0.25 | 875 | 100 | 25 | 10 | 2.5 |
| 0.5 | 850 | 100 | 50 | 10 | 5.0 |
| 1.0 | 800 | 100 | 100 | 10 | 10 |
| 2.0 | 700 | 100 | 200 | 10 | 20 |
다른 유형의 XFp HS Mini 어세이를 수행하는 경우, 적합한 주입 용액 준비 지침은 해당 XFp HS MiniKit 사용자 가이드를 참조하세요.
관련 지원 자료
- Agilent Seahorse 센서 카트리지 주입 포트 로딩
- Agilent Seahorse XFe24 센서 카트리지 주입 포트 로딩
- Agilent Seahorse XF24 센서 카트리지 주입 포트 로딩
- Agilent Seahorse XFp 센서 카트리지 주입 포트 로딩
- 세포 특성 규명: XFe96/XF96 분석기 및 Seahorse XF Real-Time ATP 생성률 어세이
- 세포 특성 규명: XF24 분석기 및 세포 에너지 표현형 테스트
- 세포 특성 규명: XFe24 분석기 및 Seahorse XF Real-Time ATP 생성률 어세이
- 세포 특성 규명: XFp 분석기 및 Seahorse XF Real-Time ATP 생성률 어세이
- 세포 특성 규명: XF HS Mini 분석기 및 XF Real-Time ATP 생성률 어세이
- 세포 특성 규명: HS miniplate와 XF Real-Time ATP 생성률 어세이를 갖춘 XF HS Mini 분석기
참고 자료
- Agilent Seahorse 어세이 가이드 및 템플릿
- Agilent Seahorse 어세이 가이드 및 템플릿
- Agilent Seahorse 어세이 가이드 및 템플릿
- Agilent Seahorse 어세이 가이드 및 템플릿
- Agilent Seahorse 어세이 가이드 및 템플릿
- Agilent Seahorse 템플릿
- 애질런트 세포 분석 발행물 데이터베이스
Agilent Cell Analysis 데이터를 사용하여 발행물의 전체 목록을 살펴보세요.
3.4 주입 용액 로드
3.5 주입 용액 로드
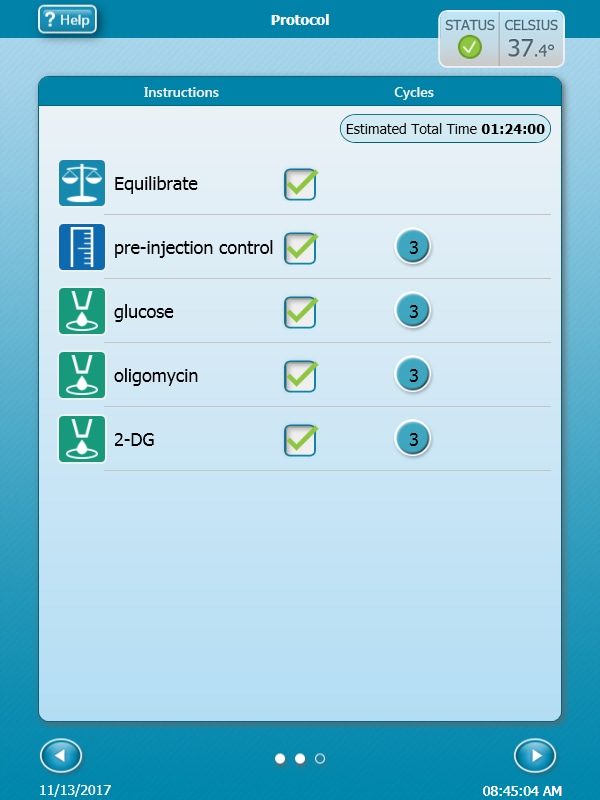
Seahorse XF Real-Time ATP 생성률 어세이를 사용하여 초기 세포 특성 규명(세포 밀도 어세이)을 수행하는 경우 아래 지침과 표에 따라 카트리지 주입 포트를 로드합니다.
세포 에너지 표현형 어세이를 사용하여 초기 세포 특성 규명(세포 밀도 및 FCCP 농도 적정 어세이)를 수행하는 경우 아래 지침과 표에 따라 카트리지 주입 포트를 로드합니다.
이러한 어세이 설계의 경우 A 그리고 B 주입 포트만 사용됩니다.
센서 카트리지 주입 포트 레이아웃
- non-CO2 인큐베이터에서 수화된 카트리지를 제거합니다.
- Agilent Seahorse XF 어세이 카트리지의 방향을 맞춥니다. 행 레이블(문자 A-H)을 왼쪽에 배치합니다. 삼각형 노치가 왼쪽 하단에 있는지 확인합니다.
- Agilent Seahorse XF 어세이 카트리지의 방향을 맞춥니다. 행 레이블(문자 A-D)을 왼쪽에 배치합니다. 삼각형 노치가 왼쪽 하단에 있는지 확인합니다.
- Agilent Seahorse XFp 어세이 카트리지의 방향을 맞춥니다. 행 레이블(문자 A-H)을 왼쪽에 배치합니다. 삼각형 노치가 왼쪽 하단에 있는지 확인합니다.
- 100 또는 200μL(멀티채널) 피펫을 사용하여 팁이 피펫에 단단히 고정되었는지 확인합니다. 피펫 팁(주입용 화합물로 채워져 있음)을 원하는 포트에 놓고 팁의 방향을 아주 약간(<5°) 기울입니다. 팁을 구멍에 완전히 밀어 넣지 않습니다.


- A/D 로딩 가이드를 어세이 카트리지 위에 평평하게 놓습니다. 문자 'A'가 왼쪽 상단 모서리에 오도록 로딩 가이드의 방향을 맞춥니다. 로딩 중에 피펫 팁이 로딩 가이드에서 빠지지 않도록 손가락 끝으로 로딩 가이드의 바깥쪽 엣지를 잡고 고정합니다.
- 10-100μL 멀티채널 피펫을 사용하여 팁이 피펫에 단단히 고정되었는지 확인합니다. 피펫 팁(주입용 화합물로 채워져 있음)을 로딩 가이드의 원하는 컬럼에 놓고 팁의 방향을 아주 약간 기울입니다. 팁을 구멍에 저항 없이 최대한 삽입하고 화합물을 분주합니다. 팁을 구멍에 완전히 밀어 넣지 않습니다.
- 팁을 45° 각도로 잡습니다. 주입 포트의 반대쪽 벽에 대한 팁의 비스듬한 면을 사용하여 주입 포트에 팁을 중간에 놓습니다.
- 포트를 통해 화합물 누수가 발생할 수 있으므로 팁을 주입 포트 바닥에 완전히 삽입하지 않습니다.
- 아래 표시된 플레이트/그룹 레이아웃에 따라 적합한 주입 용액 20μL를 포트에 부드럽게 분주합니다. 절차 전반에 걸쳐 로딩 가이드를 조심스럽게 안정화하기 위해 포트에서 팁을 빼냅니다. 기포가 생기지 않도록 주의합니다. 기포의 생성을 완화하기 위해 카트리지의 어떤 부분도 두드리지 않습니다. 이로 인해 주입 포트에서 용액이 누수될 수 있습니다.
- 수행 중인 어세이에 따라 아래 표시된 플레이트/그룹 레이아웃에 따라 적합한 주입 용액 55μL를 포트에 부드럽게 분주합니다. 포트에서 팁을 조심스럽게 빼냅니다. 기포가 생기지 않도록 주의하되, 기포의 생성을 완화하기 위해 카트리지의 어떤 부분도 두드리지 않습니다. 이로 인해 주입 포트에서 용액이 누수될 수 있습니다.
- 아래 표시된 플레이트/그룹 레이아웃에 따라 적합한 주입 용액 20μL를 포트에 부드럽게 분주합니다. 절차 전반에 걸쳐 카트리지를 조심스럽게 안정화하기 위해 포트에서 팁을 빼냅니다. 기포가 생기지 않도록 주의합니다. 기포의 생성을를 완화하기 위해 카트리지의 어떤 부분도 두드리지 않습니다. 이로 인해 주입 포트에서 용액이 누수될 수 있습니다.
- A/D 포트 로딩 가이드를 제거하고 왼쪽 상단 모서리에 'B'가 표시된 B/C 포트 로딩 가이드로 교체합니다. 주입 용액 22μl를 사용하여 위 단계를 반복하여 포트 B를 로드합니다.
- 주입 용액 62μl를 사용하여 위 단계를 반복하여 포트 B를 로드합니다.
- 주입 용액 22μl를 사용하여 위 단계를 반복하여 포트 B를 로드합니다.
- 균일한 로딩을 위해 주입 포트를 시작적으로 검사합니다. 액체는 포트에 있어야 하며, 카트리지 위에 잔여 방울이 없는지 확인합니다.
세포 밀도 적정 어세이를 위한 주입 포트 로딩
| XF Real-Time ATP Rate Assay 키트의 주입 포트 및 부피 - 세포 특성 규명 | ||||
|---|---|---|---|---|
| 포트 및 화합물 | 부피 | 10X[포트] | [최종 웰] | |
| 포트 A Oligomycin | 20µL | 55µL | 15µm | 1.5µm |
| 포트 B Rotenone + Antimycin A | 22µL | 62µL | 5µm | 0.5µm |
| 웰의 최종 농도(μM) | FCCP 그룹 | 웰 | 포트/부피(μL) |
|---|---|---|---|
| Oligo / FCCP 1.0 / 1.0 | 1.0μM | A1-D6(전체) | A/55 |
FCCP 농도 적정 어세이를 위한 주입 포트 로딩
다른 유형의 XF 어세이를 수행하는 경우 해당 XF 키트 사용자 가이드와 두 개 이상의 주입 솔루션에 대한 적합한 로딩 분석법에 대한 아래 지침을 참조하세요.
- Agilent Seahorse XF 어세이 카트리지의 방향을 맞춥니다. 행 레이블(문자 A-H)을 왼쪽에 배치합니다. 삼각형 노치가 왼쪽 하단에 있는지 확인합니다.
- Agilent Seahorse XF 어세이 카트리지의 방향을 맞춥니다. 행 레이블(문자 A-D)을 왼쪽에 배치합니다. 삼각형 노치가 왼쪽 하단에 있는지 확인합니다.
- Agilent Seahorse XF 어세이 카트리지의 방향을 맞춥니다. 행 레이블(문자 A-D)을 왼쪽에 배치합니다. 삼각형 노치가 왼쪽 하단에 있는지 확인합니다.
- A/D 로딩 가이드를 어세이 카트리지 위에 평평하게 놓습니다. 문자 'A'가 왼쪽 상단 모서리에 오도록 로딩 가이드의 방향을 맞춥니다. 로딩 중에 피펫 팁이 로딩 가이드에서 빠지지 않도록 손가락 끝으로 로딩 가이드의 바깥쪽 엣지를 잡고 고정합니다.
- 10-100μL 멀티채널 피펫을 사용하여 팁이 피펫에 단단히 고정되었는지 확인합니다. 피펫 팁(주입용 화합물로 채워져 있음)을 로딩 가이드의 원하는 컬럼에 놓고 팁의 방향을 아주 약간 기울입니다. 팁을 구멍에 저항 없이 최대한 삽입하고 화합물을 분주합니다. 팁을 구멍에 완전히 밀어 넣지 않습니다.
- 멀티채널 피펫을 사용하여 팁이 피펫에 단단히 고정되었는지 확인합니다. 피펫 팁(주입용 화합물로 채워짐)을 45° 각도로 배치합니다. 주입 포트의 반대쪽 벽에 대한 팁의 비스듬한 면을 사용하여 주입 포트에 팁을 중간에 놓습니다.
- 포트를 통해 화합물 누수가 발생할 수 있으므로 팁을 주입 포트 바닥에 완전히 삽입하지 않습니다.
- 화합물을 포트에 부드럽게 분주합니다. 포트에서 팁을 조심스럽게 빼내면서 분석을 수행하는 동안 로딩 가이드를 안정화합니다.


- 화합물을 포트에 부드럽게 분주합니다. 포트에서 팁을 조심스럽게 빼내면서 분석을 수행하는 동안 로딩 가이드를 안정화합니다.
- 기포가 생기지 않도록 주의하되, 기포의 생성을 완화하기 위해 카트리지의 어떤 부분도 두드리지 않습니다. 이로 인해 주입 포트에서 화합물 누수가 발생할 수 있습니다.
- B/C 로딩 가이드로 전환합니다. 왼쪽 상단 모서리에 있는 문자 'B'를 기준으로 방향을 맞춥니다. 적합한 로딩 가이드를 사용하여 'B', 'C' 및 'D' 주입 포트에 대해 3-5단계에 설명된 로딩 절차를 반복합니다. 로딩 가이드를 제거하여 폐기합니다.
- 'B', 'C' 및 'D' 주입 포트에 대해 위 단계에 설명된 로딩 절차를 반복합니다.
- 균일한 로딩을 위해 주입 포트를 시작적으로 검사합니다. 액체는 포트에 있어야 하며, 카트리지 위에 잔여 방울이 없는지 확인합니다.
주입에 대한 일반 정보 및 가이드라인
- 권장되는 주입 부피는 20-30μL입니다.
- 권장되는 주입 부피는 50-100μL입니다.
- 180μL 어세이 배지의 마이크로플레이트 웰 용량으로 시작하여 주입 시 10X 희석을 위한 권장 주입 용액 용량.
- 포트 A: 20μL
- 포트 B: 22μL
- 포트 C: 25μL
- 포트 D: 28μL
- 500μL 어세이 배지의 마이크로플레이트 웰 용량으로 시작하여 주입 시 10X 희석을 위한 권장 주입 용액 용량.
- 포트 A: 55μL
- 포트 B: 62μL
- 포트 C: 69μL
- 포트 D: 75μL
- 사용되는 포트의 구성, 순서 및 수는 어세이 설계에 따라 달라집니다.
- 포트 오리피스를 통해 주입 용액이 누수될 수 있으므로 자동 피펫은 카트리지 로딩에 권장되지 않습니다.
관련 지원 자료
- Agilent Seahorse XFe96 센서 카트리지 주입 포트 로딩
- Agilent Seahorse XFe24 센서 카트리지 주입 포트 로딩
- Agilent Seahorse XF24 센서 카트리지 주입 포트 로딩
- Agilent Seahorse XFp 센서 카트리지 주입 포트 로딩
- 세포 특성 규명: XFe96/XF96 분석기 및 Seahorse XF Real-Time ATP 생성률 어세이
- 세포 특성 규명: XFe24 분석기 및 Seahorse XF Real-Time ATP 생성률 어세이
- XF24 세포 특성 규명: XF24 분석기 및 세포 에너지 표현형 테스트
- 세포 특성 규명: XFp 분석기 및 Seahorse XFp Real-Time ATP 생성률 어세이
- 세포 특성 규명: XF HS Mini 분석기 및 XF Real-Time ATP 생성률 어세이
- 세포 특성 규명: HS miniplate와 XF Real-Time ATP 생성률 어세이를 갖춘 XF HS Mini 분석기
참고 자료
- Agilent Seahorse 어세이 가이드 및 템플릿
- Agilent Seahorse 어세이 가이드 및 템플릿
- Agilent Seahorse 어세이 가이드 및 템플릿
- Agilent Seahorse 어세이 가이드 및 템플릿
- Agilent Seahorse 어세이 가이드 및 템플릿
- Agilent Seahorse 템플릿
- 애질런트 세포 분석 발행물 데이터베이스
Agilent Cell Analysis 데이터를 사용하여 발행물의 전체 목록을 살펴보세요.

Seahorse에 대한 정보만 표시
기기 유형 변경4. XF 어세이 수행
이 섹션에서는 분석기에서 XF Real-Time ATP 생성률 어세이를 사용하여 초기 세포 특성 규명을 수행하는 데 중점을 둡니다.
이 섹션에서는 분석기의 세포 에너지 표현형 테스트를 사용하여 초기 세포 특성 규명을 수행하는 데 중점을 둡니다.
이 섹션에서는 XF HS Mini 분석기에서 XF Real-Time ATP 생성률 어세이를 사용하여 초기 세포 특성 규명을 수행하는 데 중점을 둡니다. 어세이 수행에 대한 자세한 내용은 XF HS Mini 사용자 가이드를 참조하세요.
중요 – XF 어세이를 시작하기 전
- 균일한 로딩을 위해 주입 포트를 시작적으로 검사합니다. 액체는 포트에 있어야 하며, 센서 카트리지 위에 잔여 방울이 없는지 확인합니다.
- 현미경으로 세포를 관찰하여 다음을 수행합니다.
- 세포 건강, 형태, 분주 균일성 및 순도(오염 없음)를 확인합니다.
- 부착 세포의 경우, 세포가 일관된 단일 층으로 부착되어 있고 세척 단계에서 씻겨 나가지 않았는지 확인합니다.
- 부유 세포의 경우 원심분리, 세척 및 배양 후 세포가 안정적으로 부착되었는지 확인합니다.
- 백그라운드 웰에 세포가 포함되어 있지 않은지 확인합니다.
어세이 수행 절차
- 이동하여 XFe 분석기의 전원이 켜져 있고 XFe 컨트롤러(컴퓨터)에 연결되어 있는지 확인합니다. Wave 컨트롤러 소프트웨어의 왼쪽 하단 모서리에 있는 위젯 패널에서 기기 연결 상태를 확인할 수 있습니다.
- 템플릿 보기에서 원하는 어세이 템플릿 파일을 두 번 클릭하여 엽니다. 어세이 템플릿이 템플릿 보기에 표시되지 않으면 공유 네트워크 드라이브 또는 USB 플래시 드라이브를 사용하여 템플릿을 전송합니다.

- 그룹 정의, 플레이트 맵 레이아웃 및 기기 프로토콜을 검토한 후 Start Run(분석 시작)을 클릭합니다.
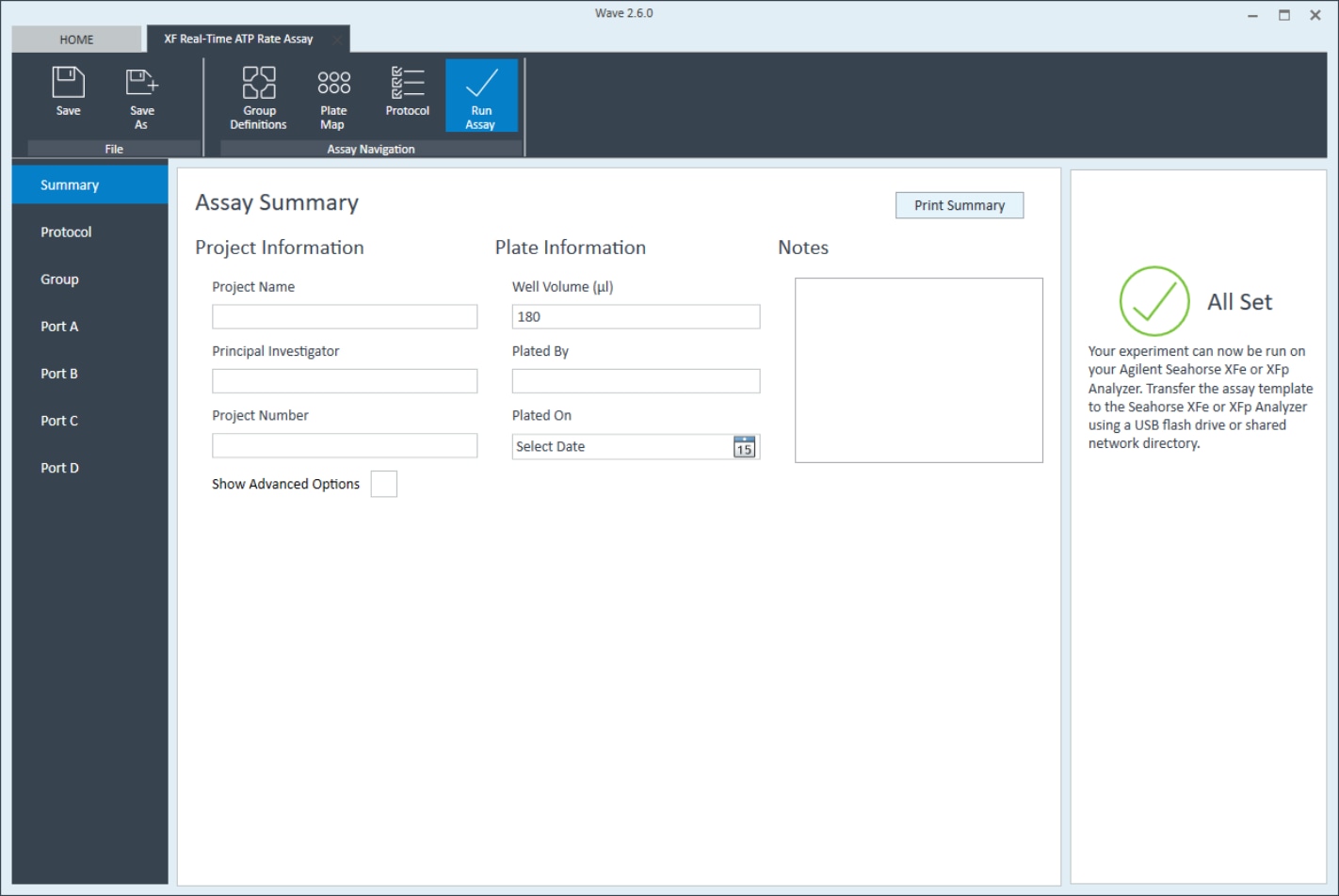

- 결과 파일의 저장 위치를 입력하면(어세이 완료 후) XFe 분석기의 트레이 도어가 열립니다.
중요! 보정을 시작하기 전에 다음 사항을 확인하세요.
- 센서 카트리지가 유틸리티 플레이트에 제대로 맞습니다.
- 센서 카트리지에서 덮개가 제거되었습니다.
- 유틸리티 플레이트에 센서 카트리지의 방향(위치)이 정확합니다.
- 메시지가 표시되면 센서 카트리지(화합물이 수화 및 로드됨)와 유틸리티 플레이트를 트레이에 놓습니다.
- I'm Ready(준비 완료)를 눌러 센서 카트리지 보정을 시작합니다.
보정을 완료하는 데 걸리는 시간은 약 10-20분입니다(37°C에서 분석하는 경우). 37°C 이외의 온도에서 수행되는 XF 어세이의 경우 정확한 데이터 수집을 위해 30분의 사전 보정 시간이 추가됩니다.
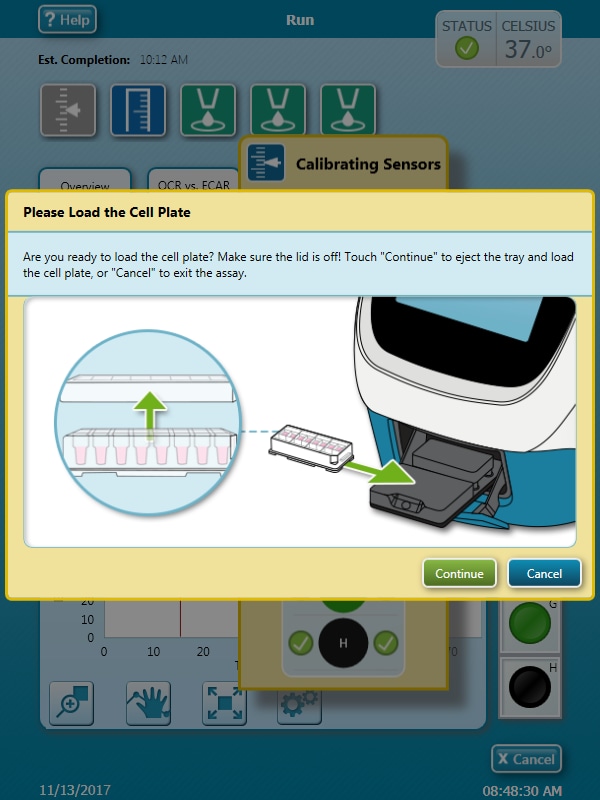
센서 카트리지 보정이 완료되면 Wave 컨트롤러에 세포 로드 플레이트 대화 상자가 표시됩니다.
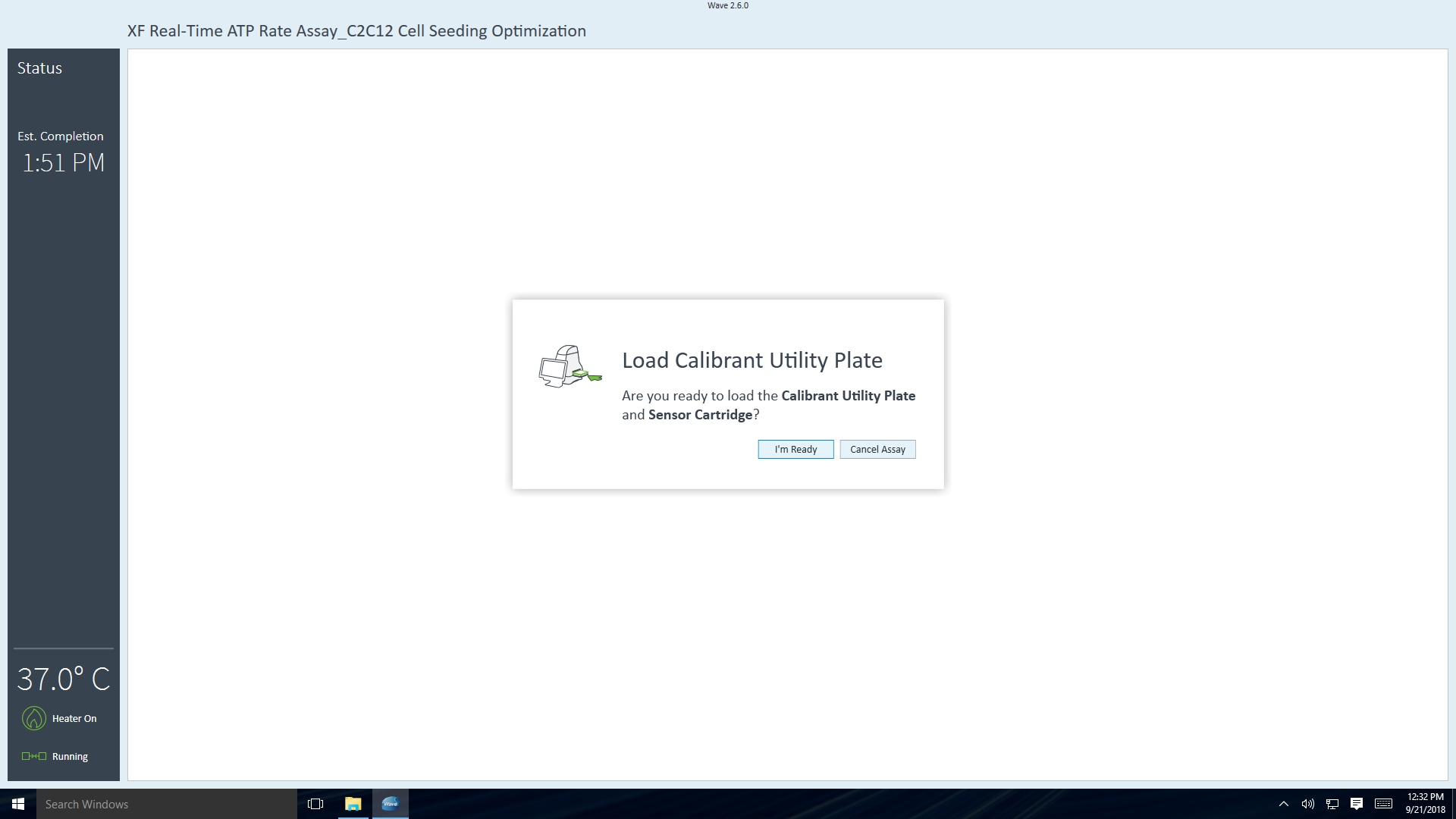
- Open Tray(트레이 열기)를 클릭하여 유틸리티 플레이트를 꺼내고 트레이에 세포 플레이트를 로드합니다. 이 단계에서는 센서 카트리지가 XFe 분석기 내부에 남아 있습니다.
중요! 세포 플레이트를 로드하기 전에 다음 사항을 확인하세요.
- 세포 카트리지에서 덮개가 제거되었습니다.
- 트레이의 세포 플레이트의 방향(위치)이 정확합니다.
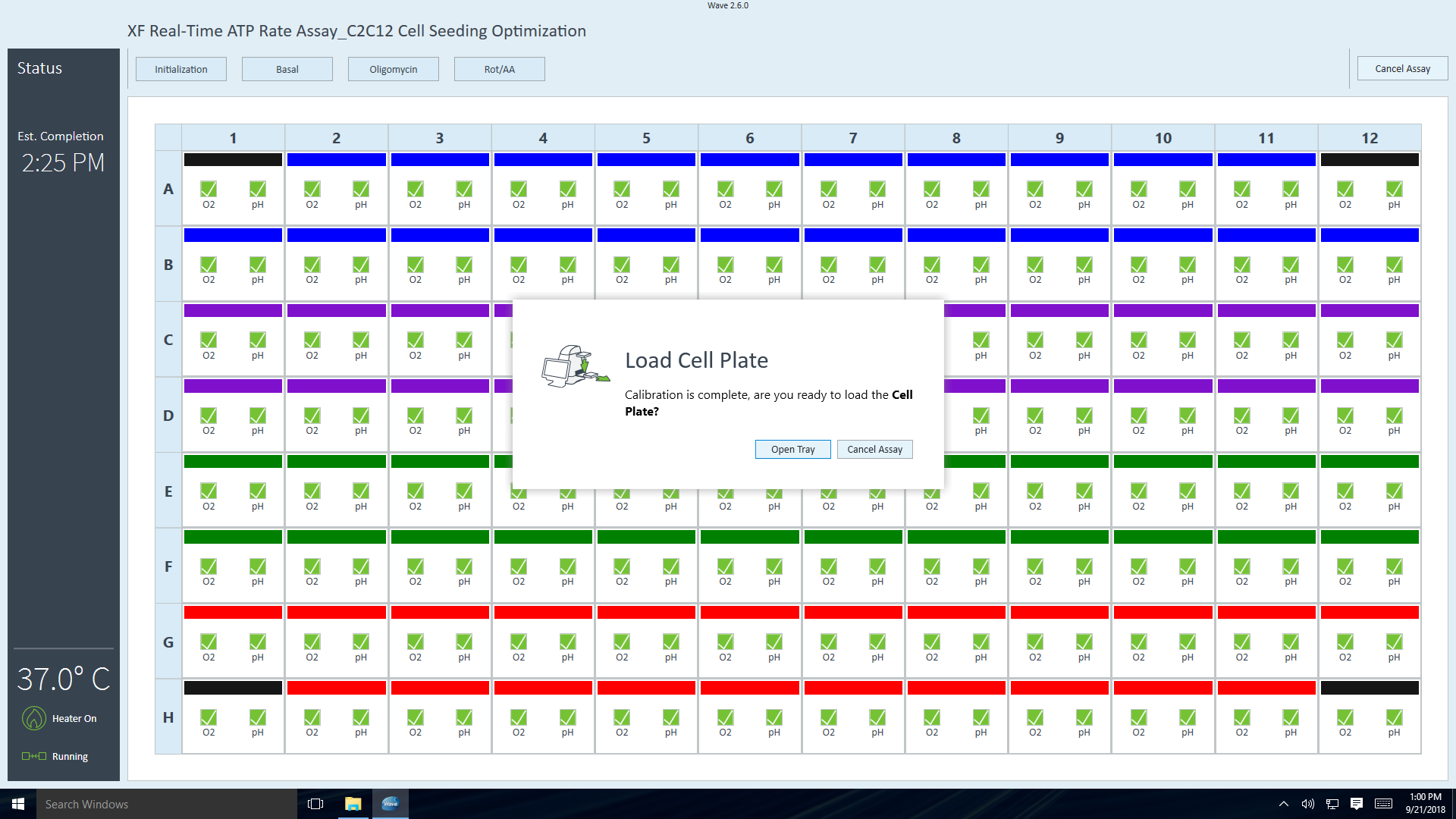
- 세포 플레이트를 트레이에 놓은 후 Load Cell Plate(세포 플레이트 로드)를 클릭하여 평형화를 시작합니다. 평형화가 완료되면 어세이가 자동으로 베이스라인 측정값을 수집하기 시작합니다(기기 프로토콜에 설명된 대로).
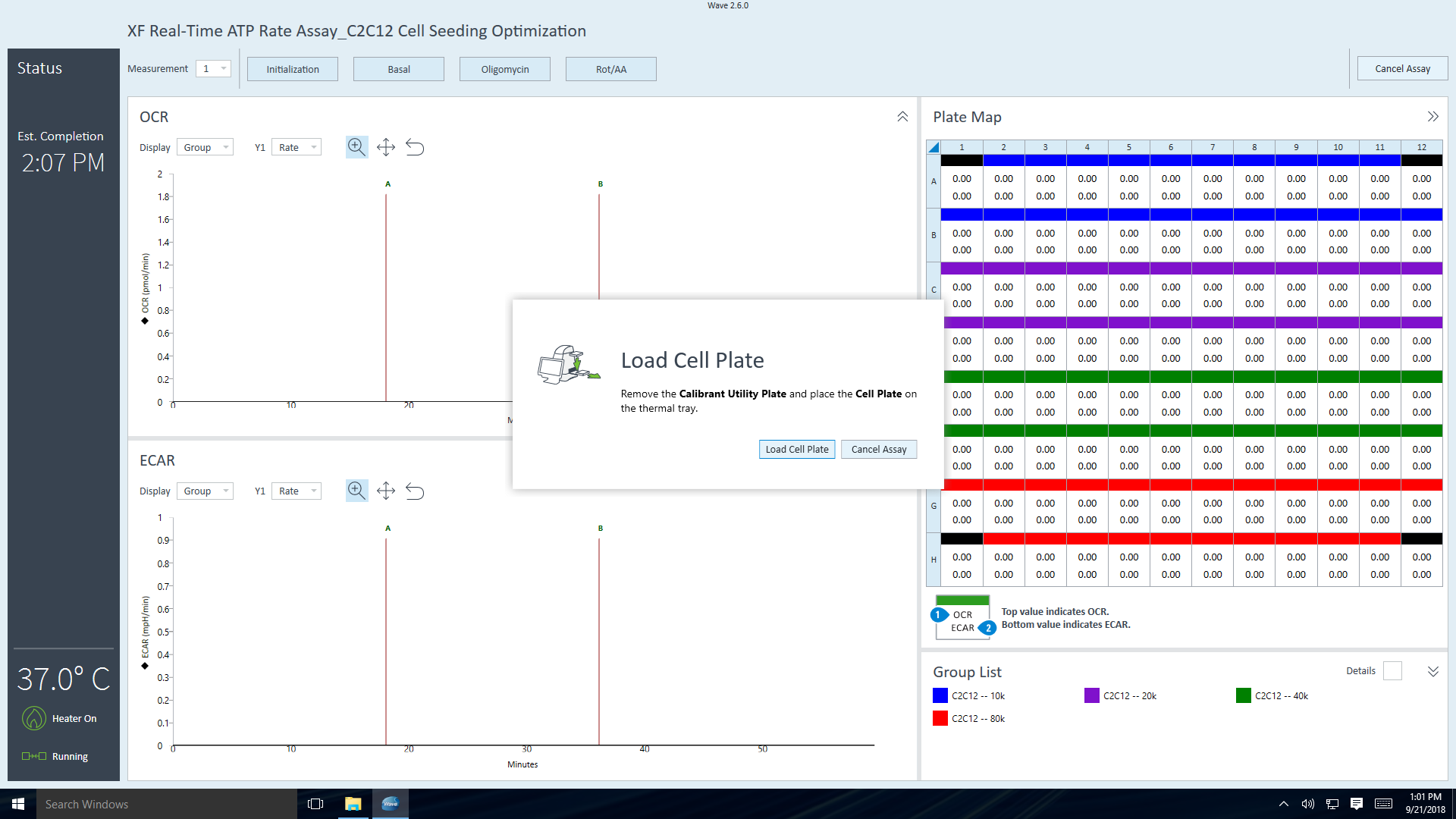
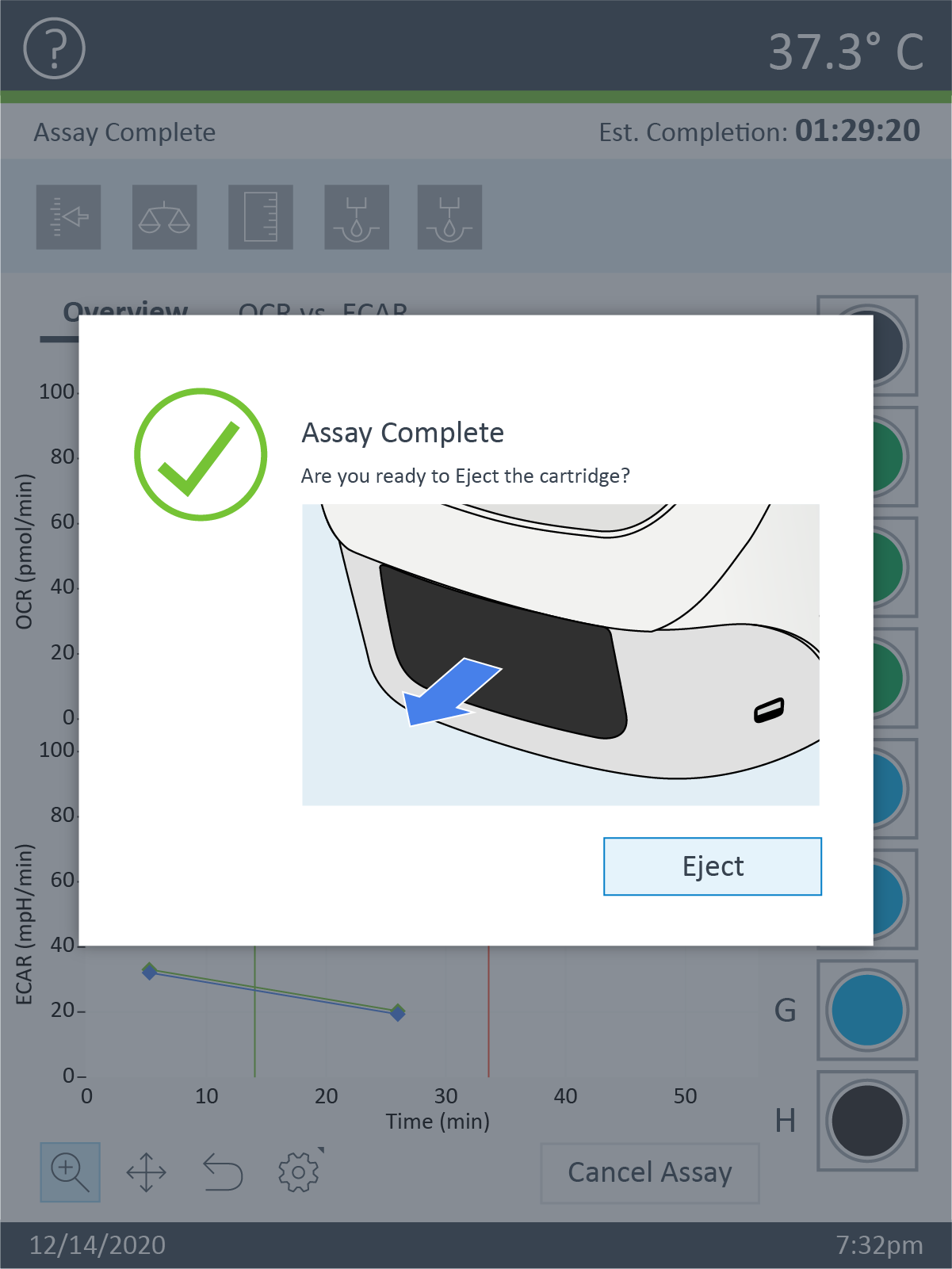
- 기기 프로토콜의 최종 측정 명령이 완료되면 Wave 컨트롤러 소프트웨어에 센서 카트리지 언로드 대화 상자가 표시됩니다.
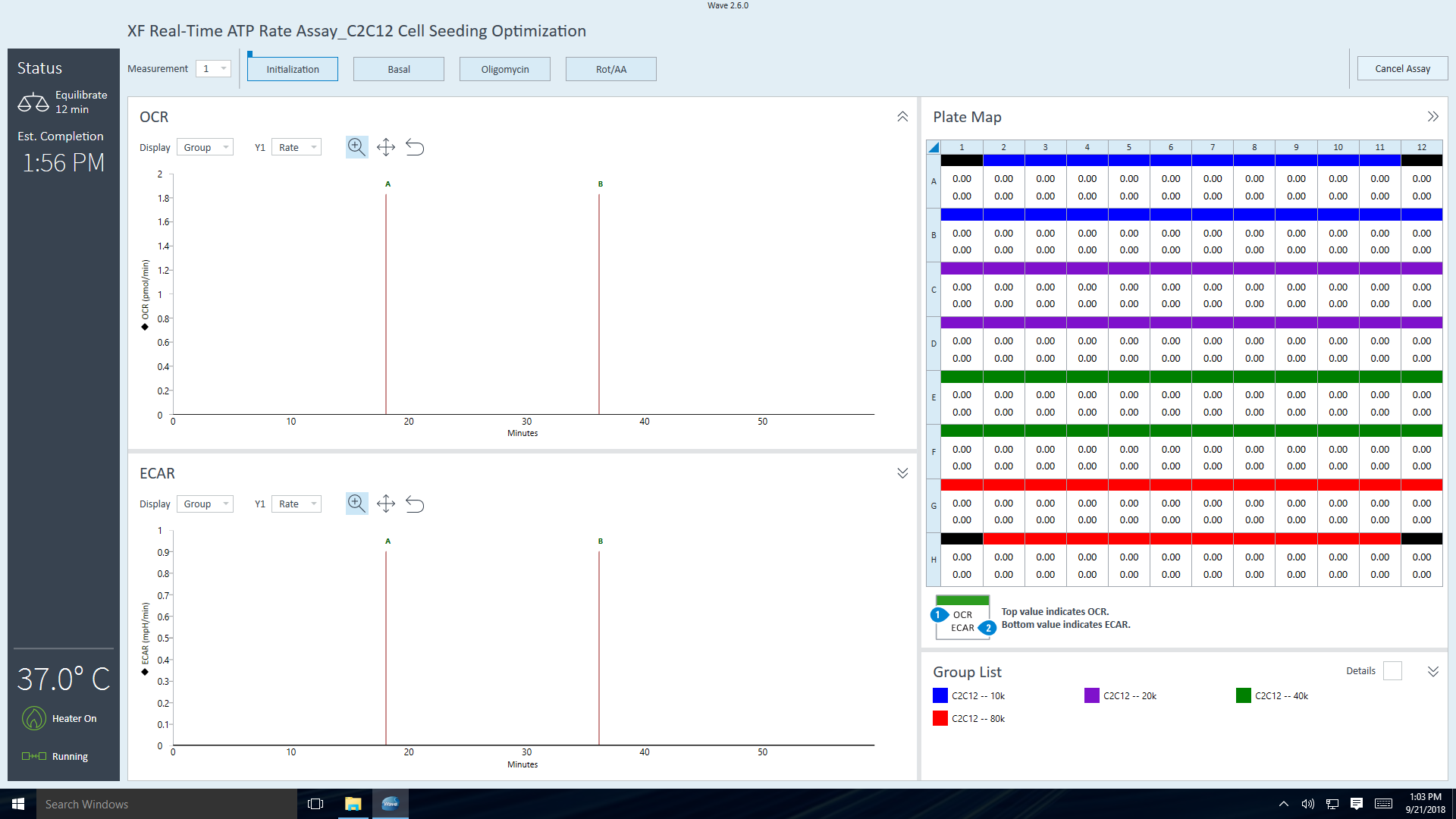
- 센서 카트리지와 세포 플레이트를 꺼낼 준비가 되면 Eject(꺼내기)를 클릭합니다. 필요한 경우 나중에 분석할 수 있도록 따로 보관합니다(예: 세포 수 정규화).
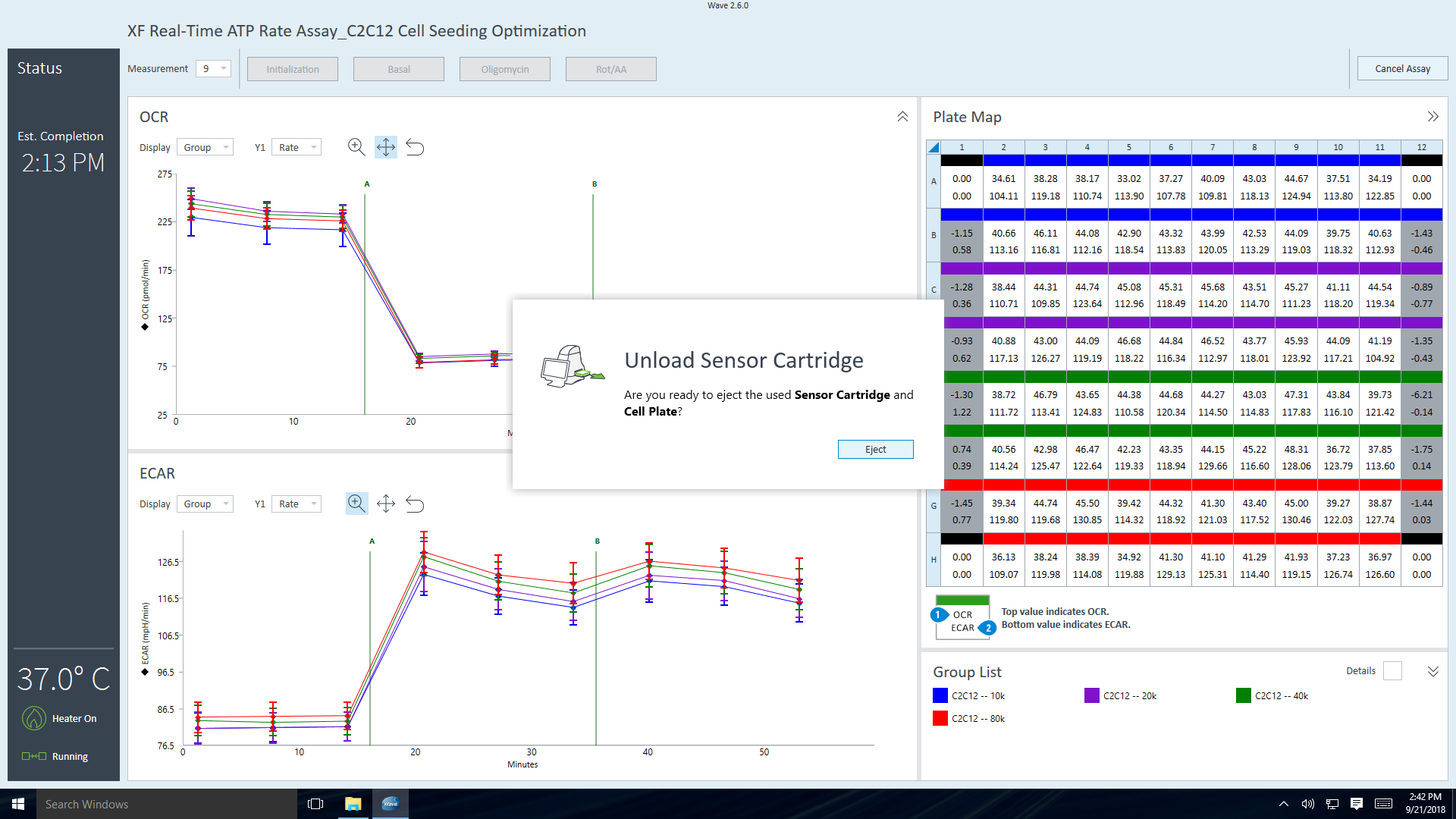
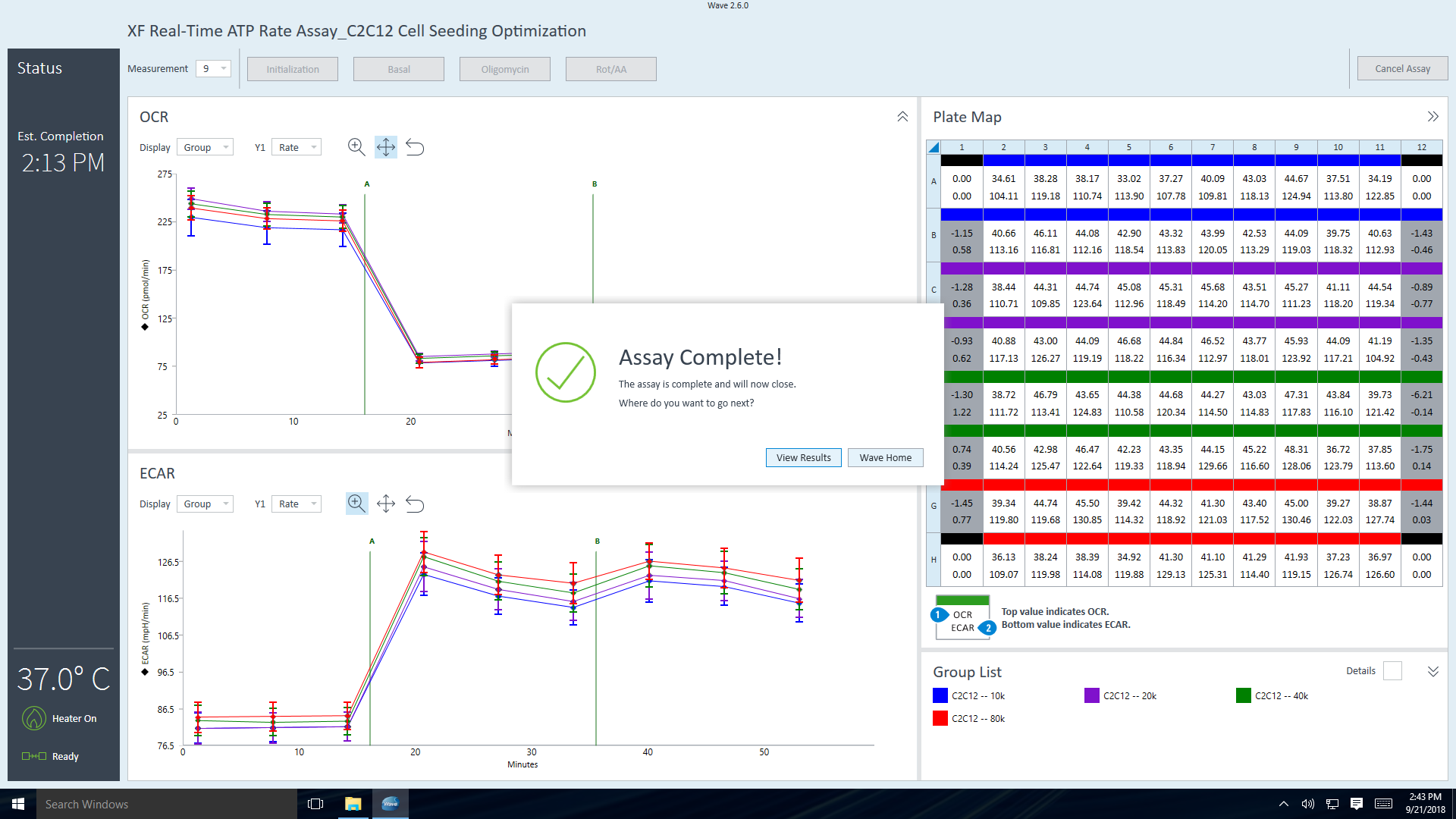
- 센서 카트리지와 세포 플레이트를 제거하면 어세이 완료 대화 상자가 나타납니다.
View Results(결과 보기)를 클릭하여 어세이 결과 파일을 즉시 열거나 Wave Home을 클릭하여 템플릿 보기로 돌아가서 다른 XFe 어세이를 시작합니다.
- 어세이 결과 파일을 공유 네트워크 드라이브 또는 USB 드라이브에 저장하거나 전송하고 데이터 분석을 위해 PC에서 Wave Desktop 소프트웨어를 사용하여 엽니다.
어세이 중 측정값을 추가/제거하는 방법, 37°C 이외의 온도에서 XFe 어세이를 위한 환경 조건 등을 포함하여 XFe 분석기 어세이 작업에 대한 자세한 내용은 Wave 사용자 가이드의 2장을 참조하세요.
어세이 수행 절차
- 필요한 주입 포트가 모두 채워지면 카트리지와 유틸리티 플레이트를 분석기로 옮기고 카트리지 보정을 시작합니다.
중요! 보정을 시작하기 전에 다음 사항을 확인하세요.
- 센서 카트리지가 유틸리티 플레이트에 제대로 맞습니다.
- 센서 카트리지에서 덮개가 제거되었습니다.
- 유틸리티 플레이트에 센서 카트리지의 방향(위치)이 정확합니다.
- 카트리지 보정이 완료되면 소프트웨어 메시지에 따라 유틸리티 플레이트를 세포 배양 플레이트로 교환하고 XF 어세이를 시작합니다.
중요! 세포 플레이트를 로드하기 전에 다음 사항을 확인하세요.
- 세포 카트리지에서 덮개가 제거되었습니다.
- 트레이의 세포 플레이트의 방향(위치)이 정확합니다.
- 어세이가 완료되면 센서 카트리지와 세포 배양 플레이트를 꺼내고 필요한 경우 나중에 분석할 수 있도록 따로 보관합니다(예: 세포 수 정규화).
- XFd 결과 파일을 공유 네트워크 드라이브 또는 USB 드라이브에 저장하거나 전송하고 어세이 데이터 분석을 위해 PC에서 Wave Desktop 소프트웨어를 사용하여 엽니다.
어세이 수행 절차
- XFp 분석기 홈 화면에서 Start(시작)을 터치하여 사용 가능한 어세이 템플릿 목록을 표시합니다.

로컬 탭에서 원하는 템플릿을 사용할 수 없는 경우 공유 네트워크 드라이브 또는 USB 플래시 드라이브를 사용하여 템플릿 파일을 열거나 전송합니다.
- XF HS Mini 분석기 홈 보기에서 Start(시작)을 터치하여 사용 가능한 어세이 템플릿 목록을 표시합니다.
- 원하는 어세이 템플릿 파일이 Wave Pro/Wave 소프트웨어 또는 Seahorse Analytics에서 생성된 경우 각각 공유 네트워크 드라이브 또는 USB 플래시 드라이브를 사용하여 어세이 템플릿 파일을 열거나 전송합니다.
- 템플릿 설계를 검토하려면 터치하여 어세이 템플릿을 엽니다.
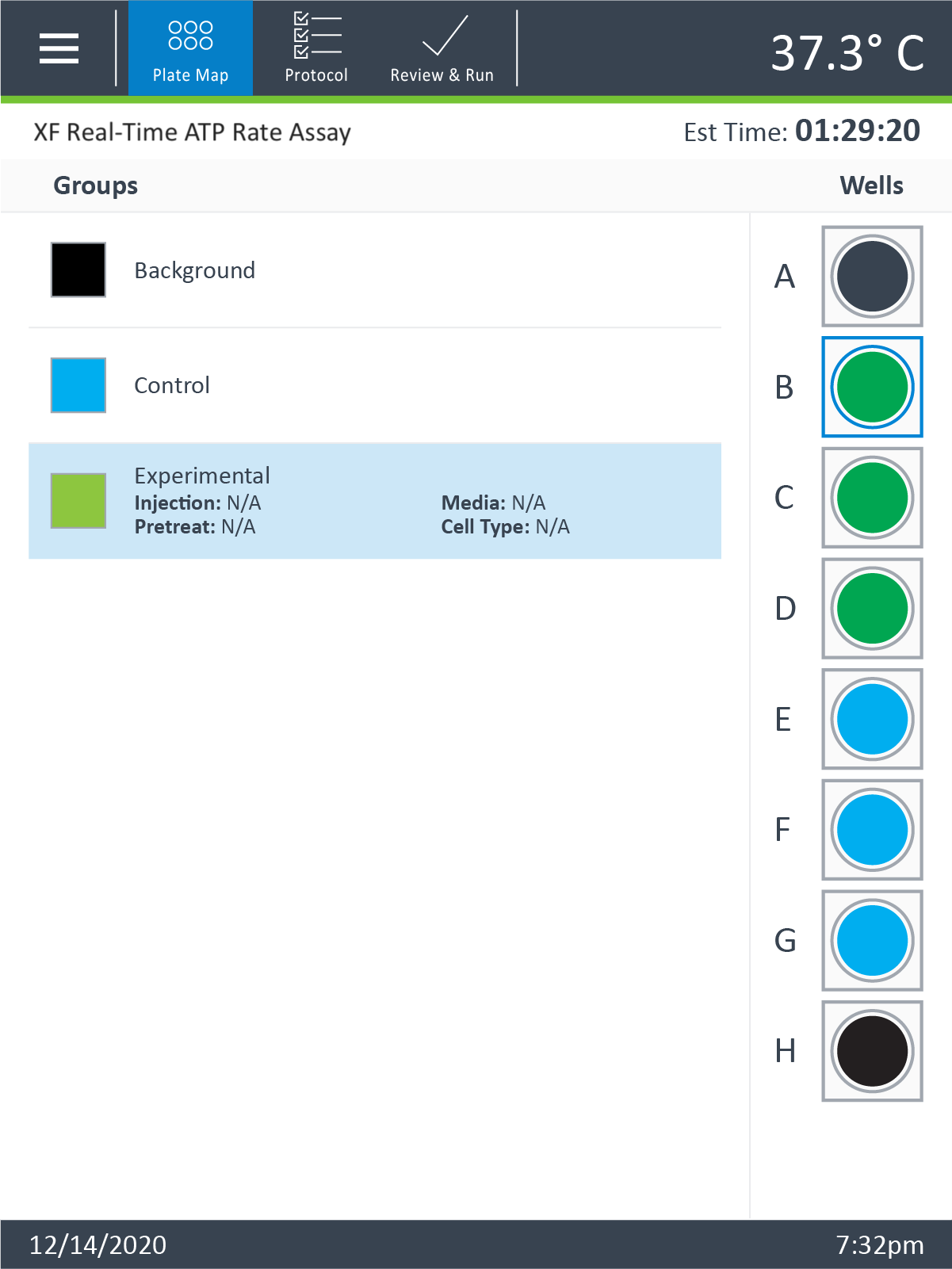
- 그룹 정의 - 그룹 이름을 터치하면 선택한 그룹에 대한 주입 전략, 전처리 및 세포 유형 정보가 표시됩니다. XFp 분석기 소프트웨어는 그룹 정의 수정을 허용하지 않으므로 Wave Desktop 소프트웨어를 사용해야 합니다.
- 플레이트 맵 - 그룹에 할당된 웰을 변경하고 먼저 그룹 이름을 터치한 다음 플레이트 맵에서 웰을 터치합니다.
- 그룹 정의 및 플레이트 맵 레이아웃을 열고 검토하려면 목록에서 템플릿을 터치합니다.
- 그룹 정의 – 그룹 이름을 터치하면 선택한 그룹에 대한 주입 전략, 전처리, 어세이 배지 및 세포 유형이 표시됩니다. Agilent Seahorse Analytics의 수정 기능을 사용하여 그룹 정의를 수정할 수 있습니다.
- 플레이트 맵 – 플레이트 맵에서 웰에 할당된 그룹을 변경하려면 먼저 목록에서 그룹 이름을 터치한 다음 플레이트 맵에서 웰을 터치합니다.
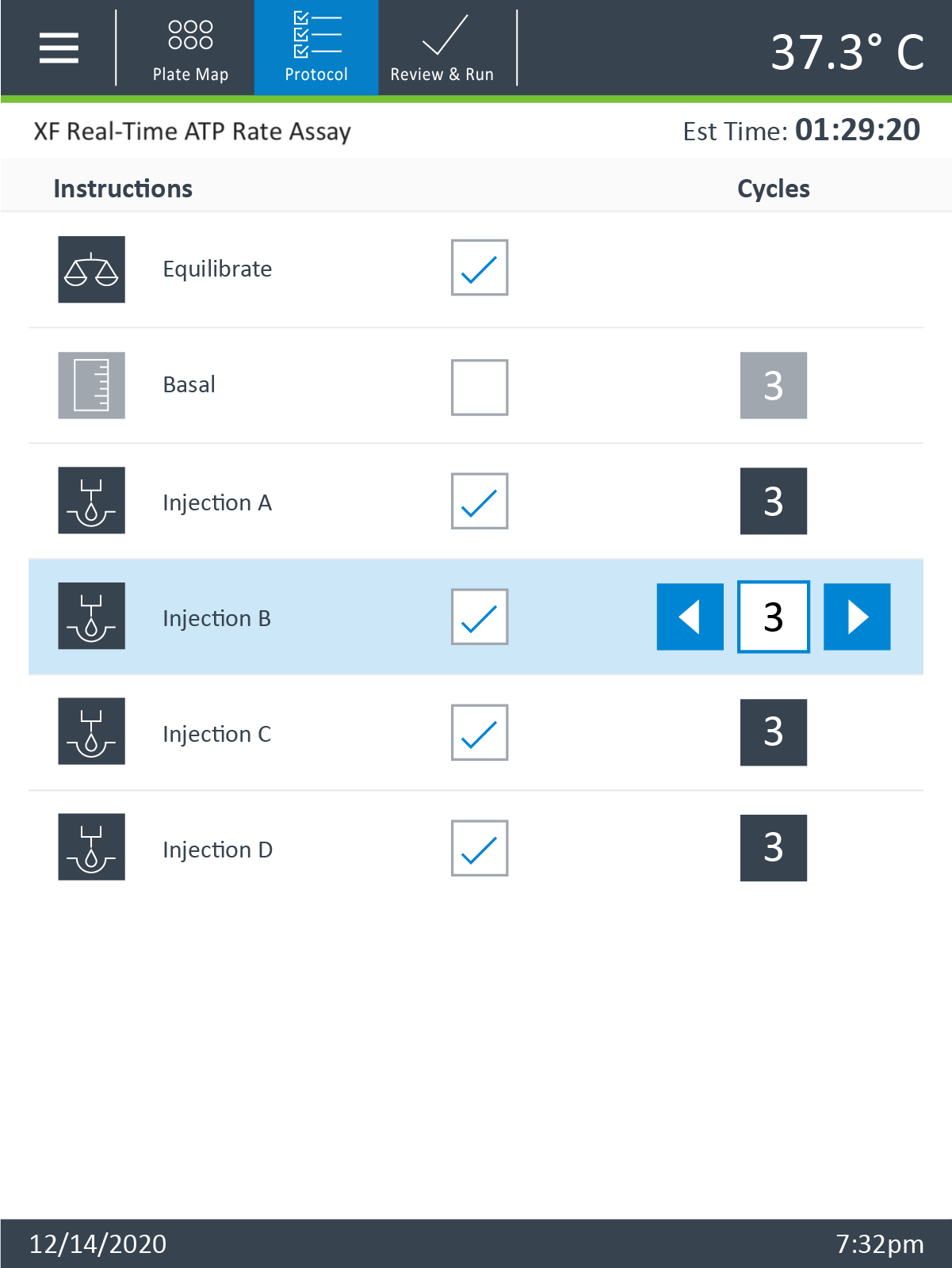
- 기기 프로토콜을 검토하거나 편집하려면 오른쪽 화살표(오른쪽 하단)를 터치합니다.
- 기기 프로토콜에서 측정 주기를 추가하거나 제거하려면 먼저 프로토콜 단계를 터치한 다음 플러스/마이너스 버튼을 사용하여 측정 주기를 조정합니다.
- XF HS Mini 디스플레이 상단의 리본에서 Protocol(프로토콜)을 터치하여 기기 프로토콜을 검토하거나 편집합니다.
- 측정 주기를 추가하거나 제거하려면 먼저 프로토콜 명령을 터치한 다음 플러스/마이너스 버튼을 사용하여 측정 주기 수를 조정합니다.
- 기기 프로토콜을 검토하거나 편집하려면 오른쪽 화살표(오른쪽 하단)를 터치합니다.
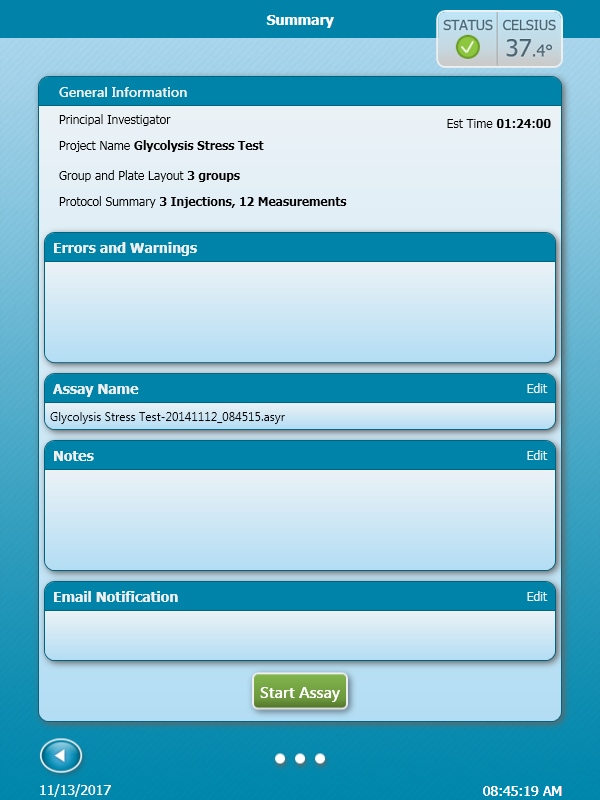
- Assay Name(어세이 명칭) 옆의 Edit(편집)을 눌러 어세이 결과 파일의 이름을 사용자 지정합니다.
- Notes(메모) 옆의 Edit(편집)을 눌러 어세이와 관련된 사용자 지정 메모를 추가합니다.
- Email Notification(이메일 알림) 옆의 Edit(편집)을 눌러 수신자에게 사용자 상호 작용(예: 유틸리티 플레이트를 세포 플레이트로 교체)을 알리고 어세이 완료 후 어세이 결과 파일을 자동으로 보내도록 합니다. 이 기능을 사용하려면 XFp 분석기에서 인터넷 연결이 활성화되어 있어야 합니다.
- XF HS Mini 디스플레이 상단의 리본에서 Review & Run(검토 및 실행)을 터치하여 실행합니다.
- 어세이 결과 파일 이름을 편집합니다.
- 어세이에 대한 메모를 추가합니다.
- 경고 알림을 검토합니다.
- 사용자 상호 작용이 필요할 때 XF HS Mini 분석기로부터 자동 알림을 받으려면 이메일 주소를 입력하고 어세이가 완료되면 어세이 결과 파일의 사본을 입력하세요. 이 기능을 사용하려면 인터넷 연결이 활성화되어 있어야 합니다.
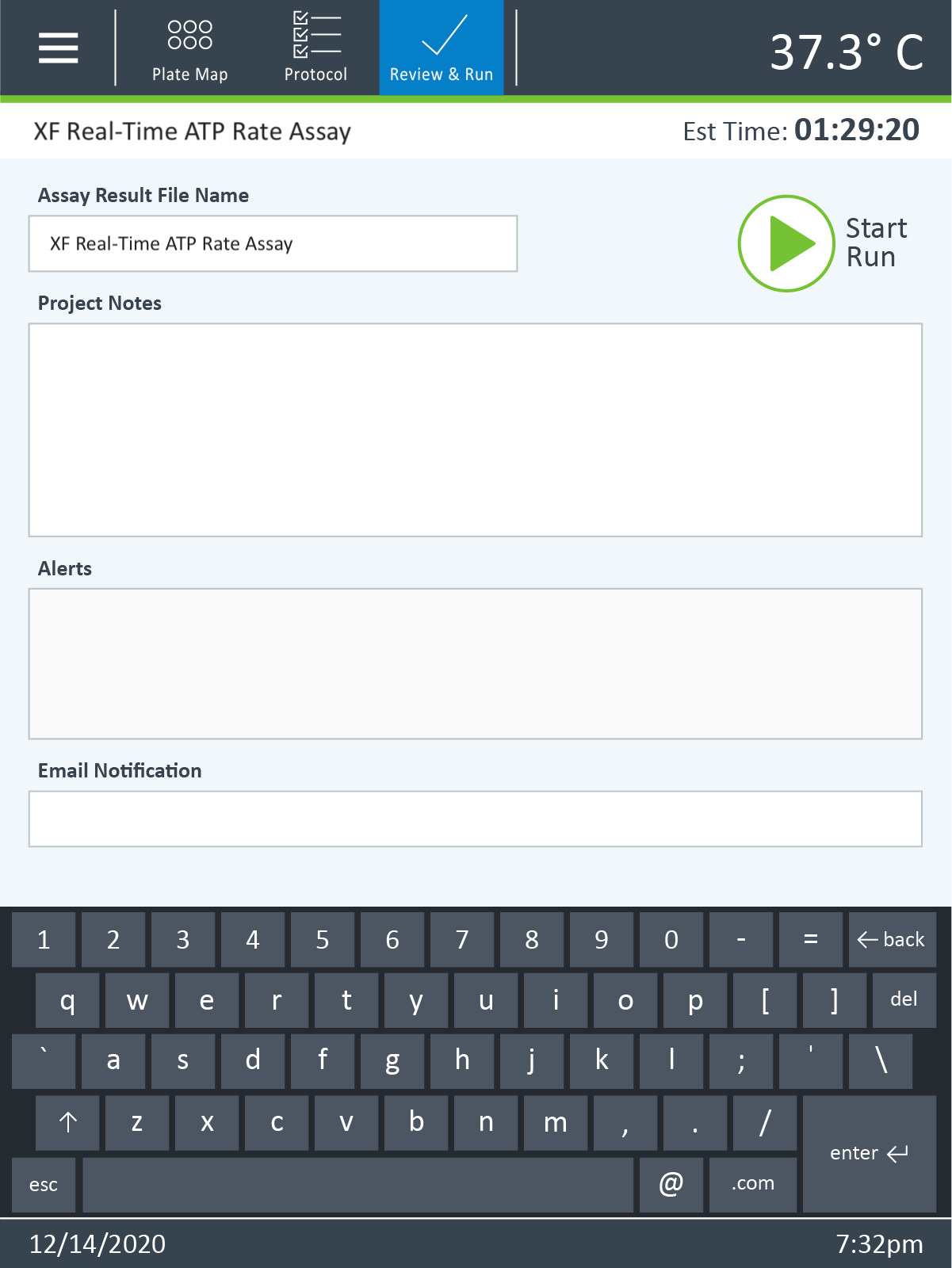
- XF 어세이를 시작할 준비가 되면 Start Assay(어세이 시작)를 클릭합니다.
- 메시지가 표시되면 센서 카트리지(화합물이 수화 및 로드됨)와 유틸리티 플레이트를 트레이에 놓습니다.
중요! 세포 플레이트를 로드하기 전에 다음 사항을 확인하세요.
- 센서 카트리지가 유틸리티 플레이트에 제대로 맞습니다.
- 센서 카트리지에서 덮개가 제거되었습니다.
- 유틸리티 플레이트에 센서 카트리지의 방향(위치)이 정확합니다.

- XF 어세이를 시작할 준비가 되면 Start Run(분석 시작)을 터치합니다.
- 화면의 지시에 따라 캘리브레이션 용액 유틸리티 플레이트와 센서 카트리지(주입용 화합물이 수화 및 로드됨)를 로드합니다.
중요! 보정을 시작하기 전에 다음 사항을 확인하세요.
- 센서 카트리지가 캘리브레이션 용액 유틸리티 플레이트에 제대로 맞습니다.
- 센서 카트리지 덮개가 제거되었습니다.
- 센서 카트리지 + 캘리브레이션 용액 유틸리티 플레이트가 트레이에 정확하게 배치되어 있습니다.
보정을 시작할 준비가 되면 Close Tray(트레이 닫기)를 누릅니다.
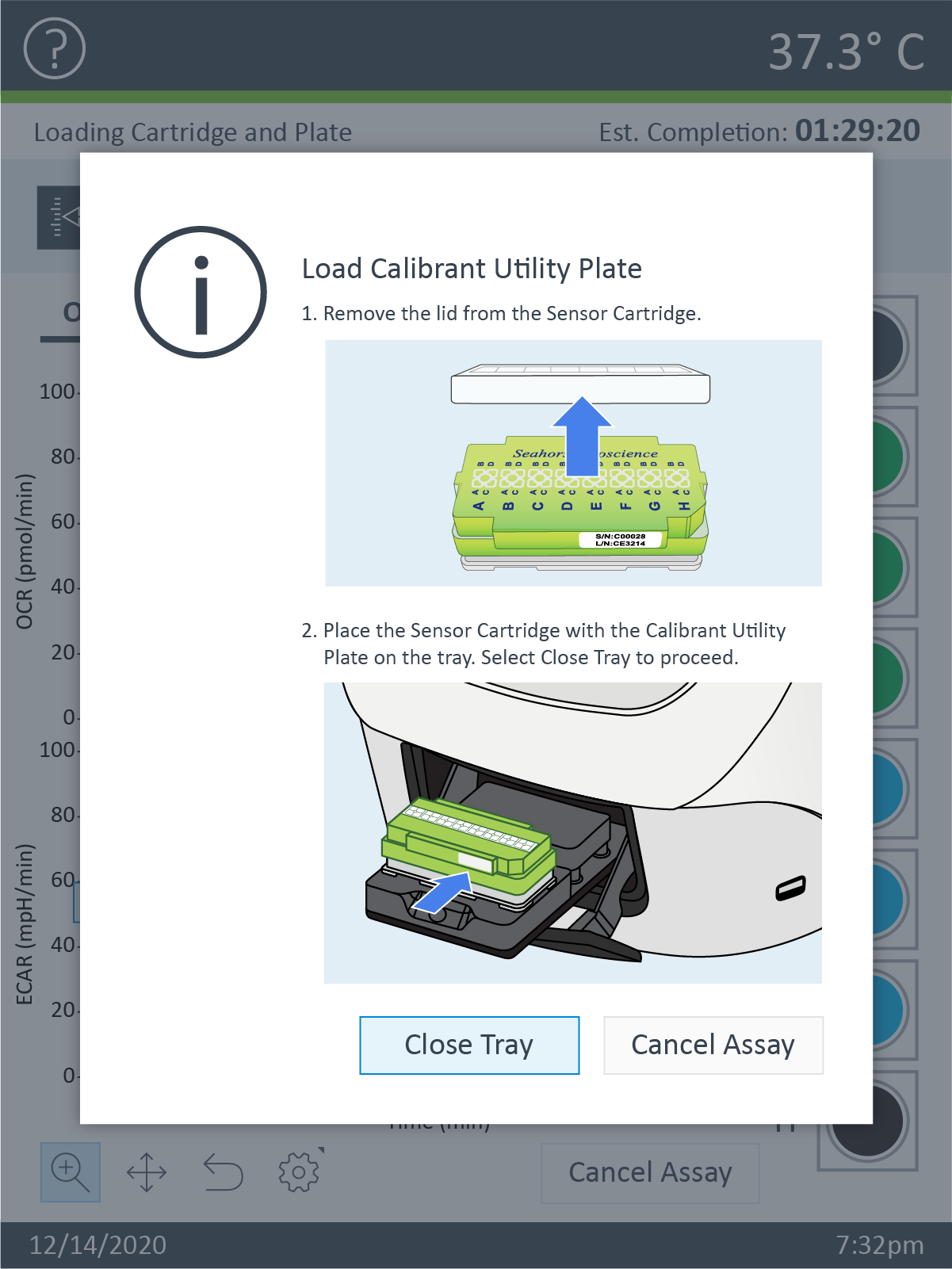
- 보정이 완료되면 XFp 분석기 트레이가 열리고 유틸리티 플레이트가 표시됩니다. 유틸리티 플레이트를 제거하고 트레이에 세포 플레이트를 로드합니다.
중요! 세포 플레이트를 로드하기 전에 다음 사항을 확인하세요.
- 세포 카트리지에서 덮개가 제거되었습니다.
- 트레이의 세포 플레이트의 방향(위치)이 정확합니다.
어세이를 시작할 준비가 되면 Continue(계속)를 누릅니다.
- 보정이 완료되면 Open Tray(트레이 열기)를 눌러 보정 유틸리티 플레이트를 표시합니다. 보정 유틸리티 플레이트를 제거하고 세포 플레이트를 트레이에 놓습니다.
중요! 어세이를 시작하기 위해 세포 플레이트를 로드하기 전에 다음 사항을 확인하세요.
- 세포 플레이트 덮개가 제거되었습니다.
- 센서 카트리지 + 캘리브레이션 용액 유틸리티 플레이트가 트레이에 정확하게 배치되어 있습니다.
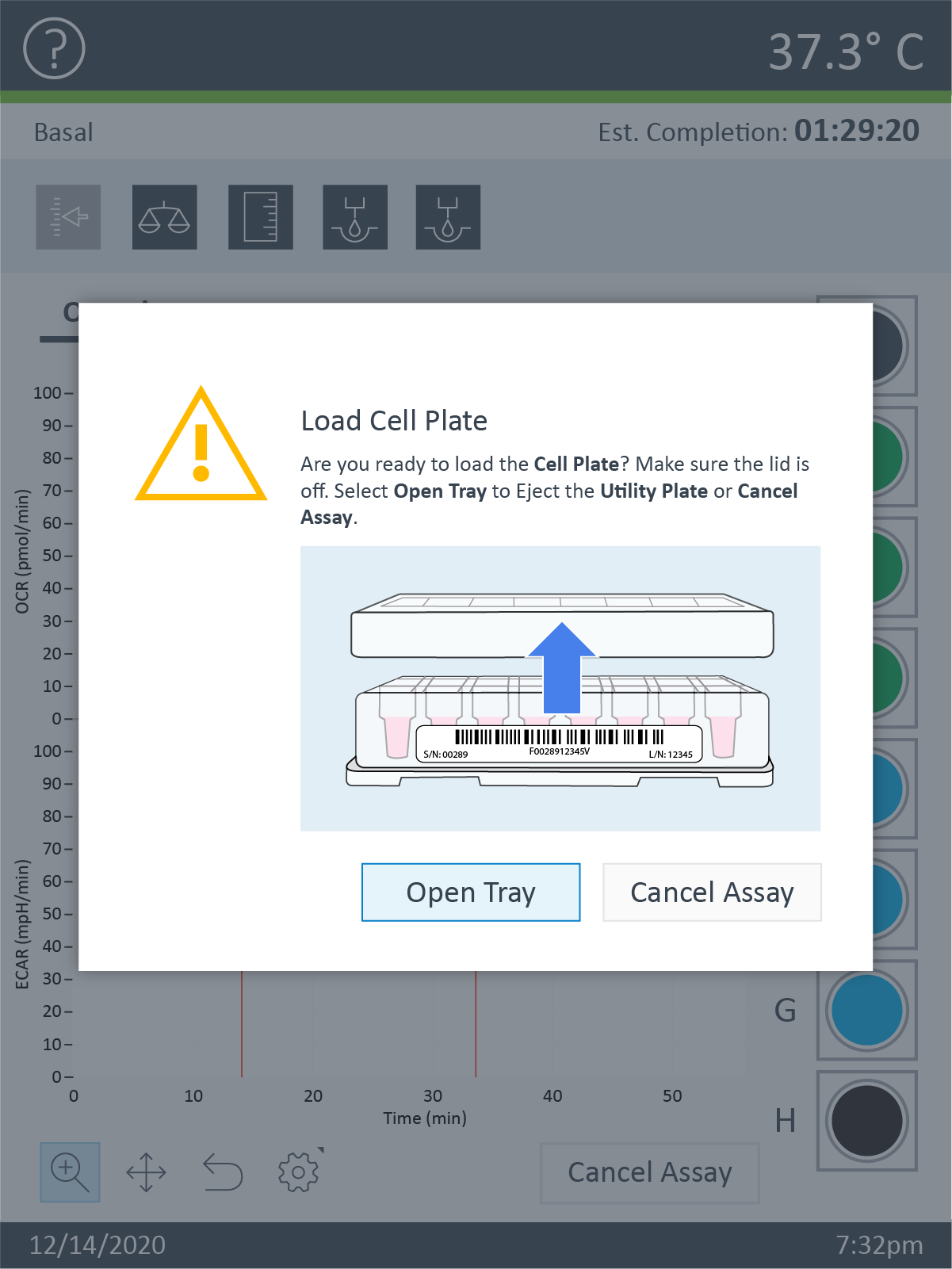
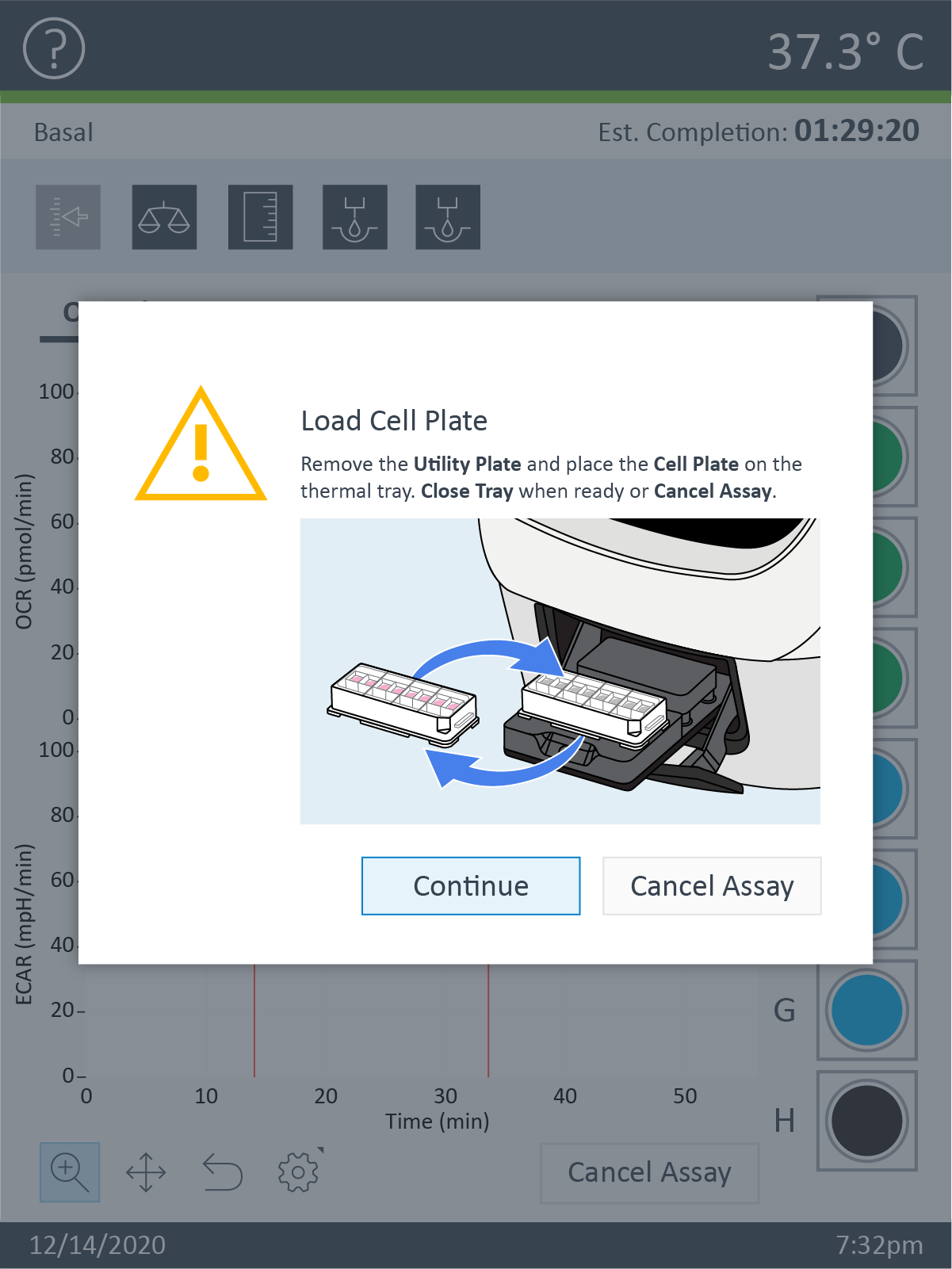
참고: XF HS Miniplate를 XF HS Mini 분석기에 로드하면 화면에 실리콘 마스크를 제거하라는 알림이 표시됩니다. 이는 간섭과 기기 손상을 방지하기 위해 수행되어야 합니다.
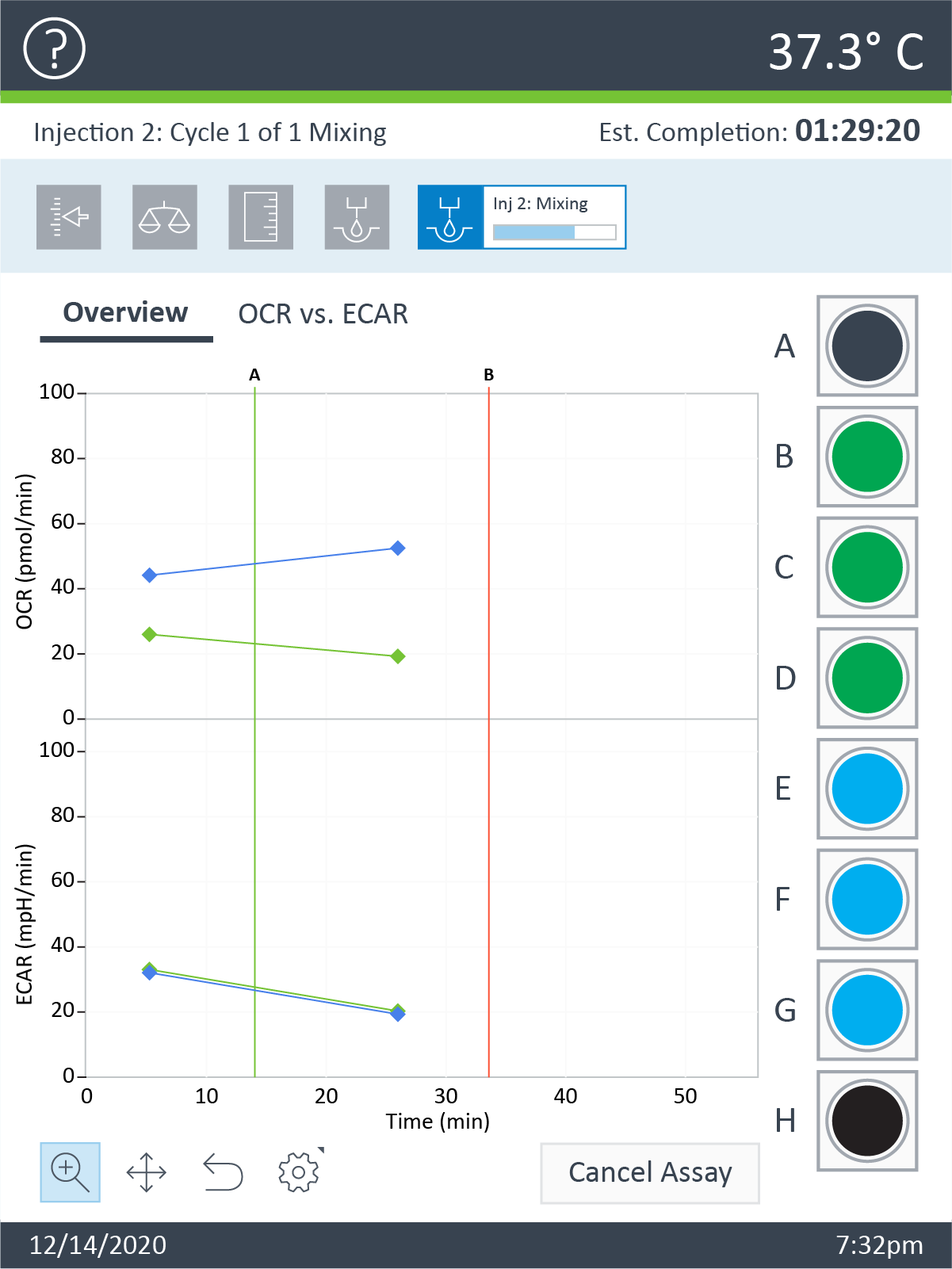
- 세포 플레이트를 트레이에 놓은 후 Continue(계속)를 터치하여 평형화를 시작합니다. 평형화가 완료되면 어세이가 자동으로 베이스라인 측정값을 수집하기 시작합니다(기기 프로토콜에 설명된 대로).
- 어세이의 첫 번째 단계를 평형화라고 합니다. 평형화가 완료되면 분석기는 첫 번째 베이스라인 측정(기기 프로토콜에 정의된 대로)을 획득하기 시작합니다. 보기 중앙의 데이터 디스플레이 위에서 기기 프로토콜의 현재 명령과 완료된 명령을 볼 수 있습니다.
- 기기 프로토콜의 최종 측정 명령이 완료되면 플레이트 및 카트리지 제거 대화 상자가 나타납니다. Continue(계속)를 클릭하여 센서 카트리지와 세포 플레이트를 꺼냅니다. 필요한 경우 나중에 분석할 수 있도록 따로 보관합니다(예: 세포 수 정규화).
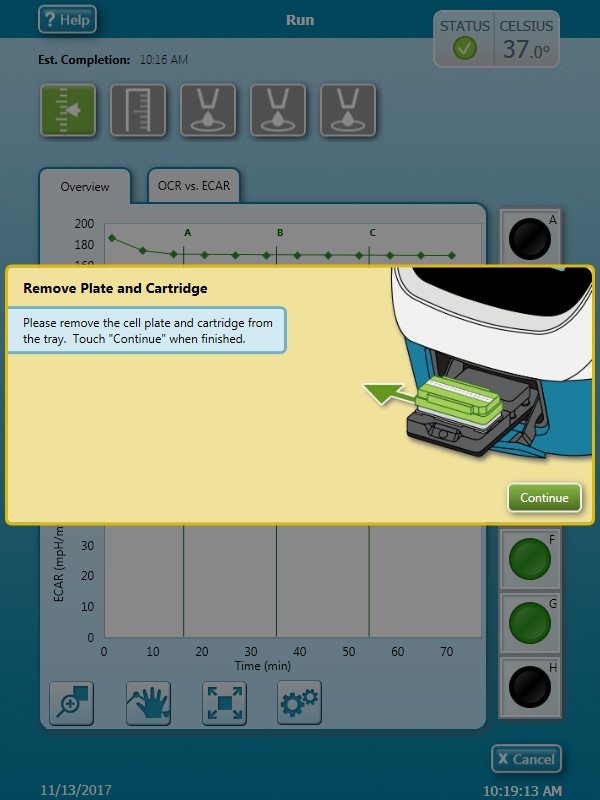
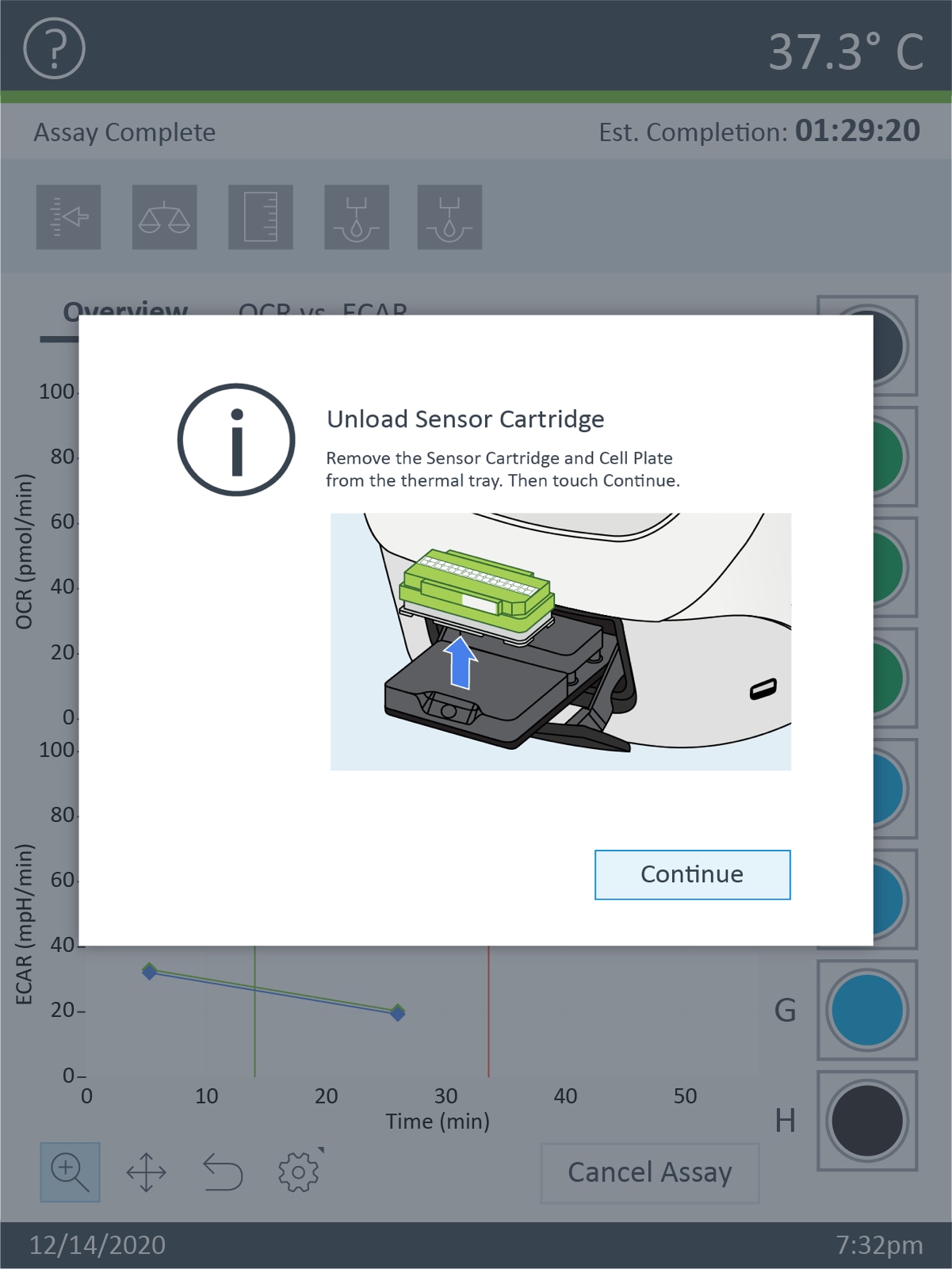
- 기기 프로토콜의 최종 측정이 완료되면 Eject(꺼내기)를 눌러 센서 카트리지와 세포 플레이트를 XF HS Mini에서 꺼냅니다. 트레이가 완전히 꺼내지면 트레이에서 센서 카트리지와 세포 플레이트를 분리하고 필요한 경우 추가 분석을 위해 따로 보관합니다(예: 세포 수 정규화). Continue(계속)를 눌러 트레이를 닫습니다.
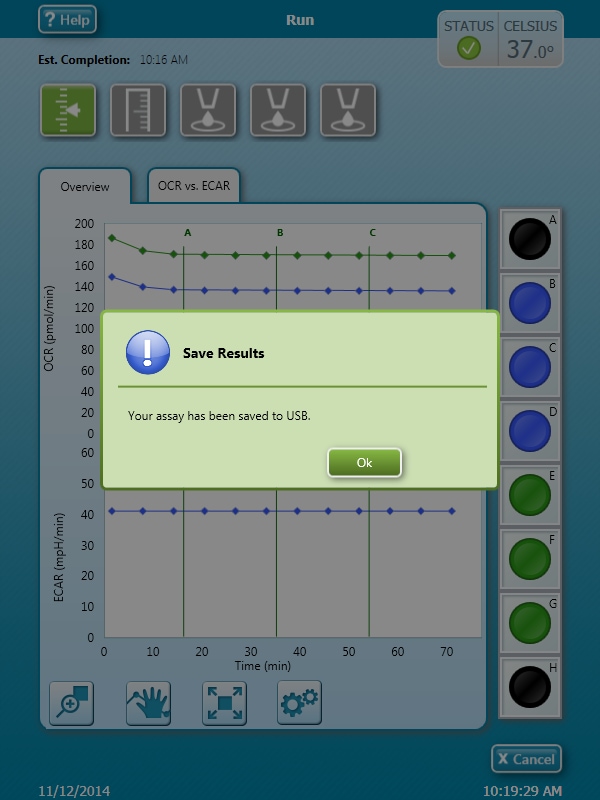
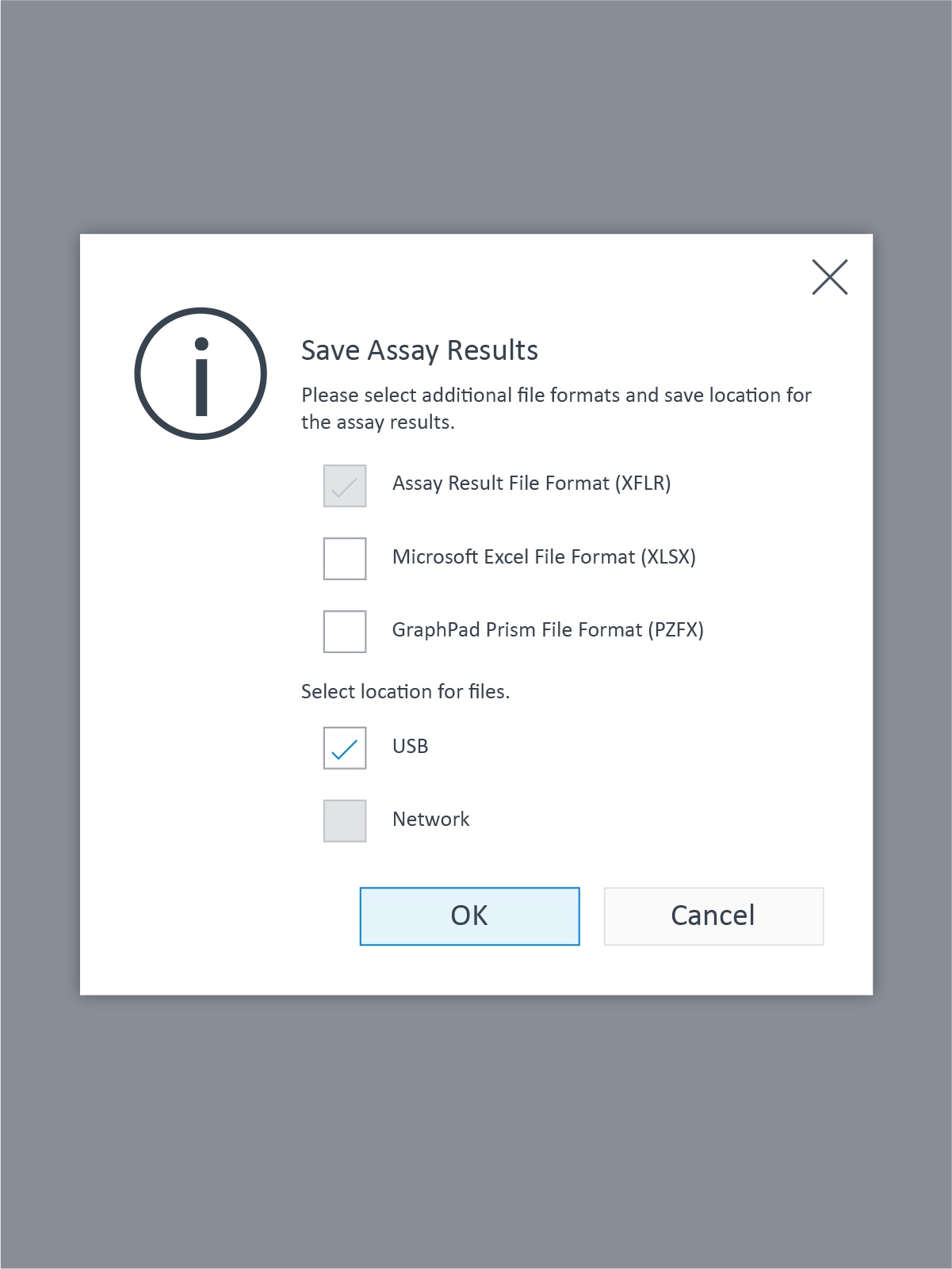
- 어세이 결과 파일을 공유 네트워크 드라이브 또는 USB 드라이브에 저장하거나 전송하고 데이터 분석을 위해 PC에서 Wave Desktop 소프트웨어를 사용하여 엽니다.
- 어세이 결과 파일 및 기타 데이터 파일 형식을 XF HS Mini에서 저장할 위치(USB 또는 네트워크)를 선택한 다음 OK(확인)를 클릭합니다. Seahorse Analytics 계정에 로그인하고 데이터 분석을 위해 XF HS Mini 어세이 결과 파일을 업로드합니다.
관련 지원 자료
- XF24 소프트웨어 다운로드
- XF96 소프트웨어 다운로드
- 설치 및 문제해결 가이드
- XF24 소프트웨어 ReadMe 설치 가이드
- XF96 소프트웨어 ReadMe 설치 가이드
- XFp 세포 외 흐름(flux) 분석기 사용자 가이드
- XF HS Mini 세포 외 흐름(flux) 분석기 사용자 가이드
- XFp 네트워크 설정 가이드
- XF HS Mini 네트워크 설정 가이드
- Wave 사용자 가이드
- XFe 네트워크 가이드
- Agilent Seahorse XF Real Time ATP 생성률 어세이 템플릿
- Agilent XF Real Time ATP 생성률 어세이 결과 데이터를 분석하는 방법
- 기술 개요: 세포 특성 규명 - OCR 값을 사용하여 최적의 분주 밀도 결정
- 기술 개요: 세포 특성 규명 - OCR 값을 사용하여 최적의 분주 밀도 결정
- Seahorse XF HS Mini 소프트웨어 업데이트(2021년 2월)

Seahorse에 대한 정보만 표시
기기 유형 변경5. XF 어세이 결과 분석
XF 어세이 결과 분석 섹션에서는 Agilent Seahorse Analytics의 기초와 Seahorse Analytics을 사용하여 XF Real-Time ATP 생성률 어세이 결과 파일을 분석하는 방법에 대해 알아봅니다. Wave Desktop 및 Report Generator에 대한 도움말 콘텐츠를 찾고 계신다면 여기를 클릭하세요.
Seahorse Analytics는 바탕 화면과 같은 상호 작용과 배우기 쉬운 인터페이스를 제공하는 웹 기반 소프트웨어 응용으로, 전 세계 어디서나 모든 컴퓨터에서 Agilent Seahorse XFe, XFp 및 XF HS Mini 분석기의 결과 데이터를 분석할 수 있습니다. 인터넷에 접속할 수만 있다면 Seahorse Analytics로 Seahorse 데이터를 분석할 수 있습니다.
참고: XF96 사용자의 경우 먼저 Wave Desktop 소프트웨어를 사용하여 .xfd 결과 파일을 어세이 결과 파일 형식으로 변환해야 합니다. .xfd 결과 파일은 Seahorse Analytics에서 분석할 수 없습니다.
자세히 알아보려면 아래에서 주제를 선택하세요.
5.1 소개
Agilent Seahorse Analytics는 Seahorse 분석기를 위한 데이터 분석 소프트웨어로, 결과를 쉽게 가져와서 분석하고 보고하며 팀 또는 공동 작업자와 결과를 공유할 수 있습니다.
Agilent Seahorse Analytics에 대한 기초:
| 사양 | 세부사항 |
|---|---|
| 사용 목적 | 데이터 분석 |
| Seahorse 데이터 파일 호환성 | XFe96 어세이 결과 파일 |
| XFe24 어세이 결과 파일 | |
| XFp 어세이 결과 파일 | |
| XF HS Mini 어세이 결과 파일 | |
| 인터넷 브라우저 호환성 | Google Chrome |
| Safari | |
| Mozilla Firefox | |
| Microsoft Edge Internet Explorer 사용을 권장하지 않습니다. |
|
| 내보내기 옵션 | Microsoft Excel (.xlsx) |
| Graphpad Prism (.pzfx) | |
| 이미지 파일(.JPG 및 .PNG) |
Seahorse Analytics 사용자 인터페이스에 익숙해지기
홈 보기:
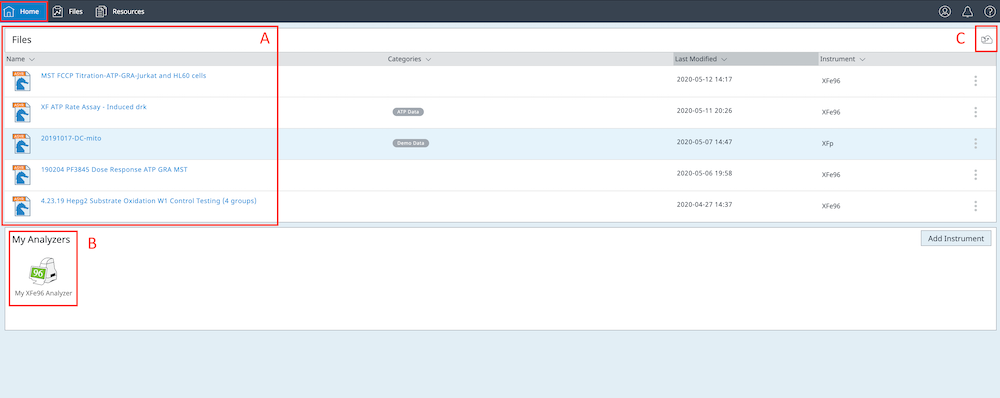
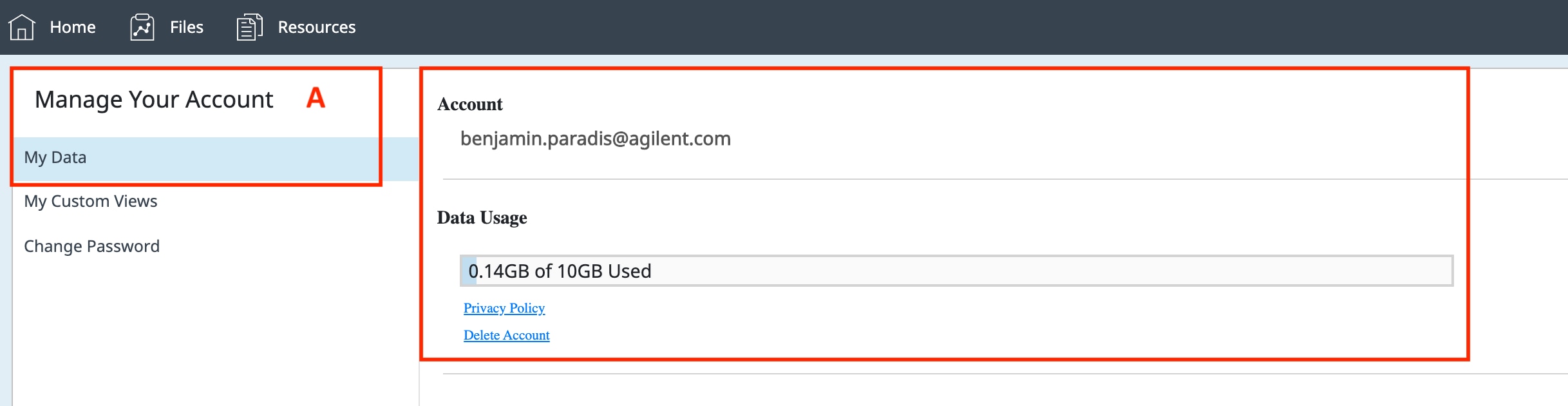
Seahorse Analytics 계정을 등록하거나 로그인하면 Home(홈) 보기(아래 그림)이 나타납니다 Home(홈) 보기로 돌아가려면 진한 파란색 탐색 리본의 왼쪽 상단 모서리에 있는 Home(홈) 버튼을 클릭합니다.
- Home(홈) 보기의 데이터 파일 목록에는 파일 공유에서 가져오거나 편집 및/또는 수신한 가장 최근의 파일 5개가 표시됩니다.
- 파일 목록 아래에는 하나 이상의 Seahorse XF 분석기를 프로필에 할당할 수 있는 내 분석기가 표시됩니다.
- Home(홈) 보기에서 데이터 파일을 가져오려면 파일 목록 위의 오른쪽 상단에 있는 작은 File Upload(파일 업로드) 버튼을 클릭합니다.
파일 보기:
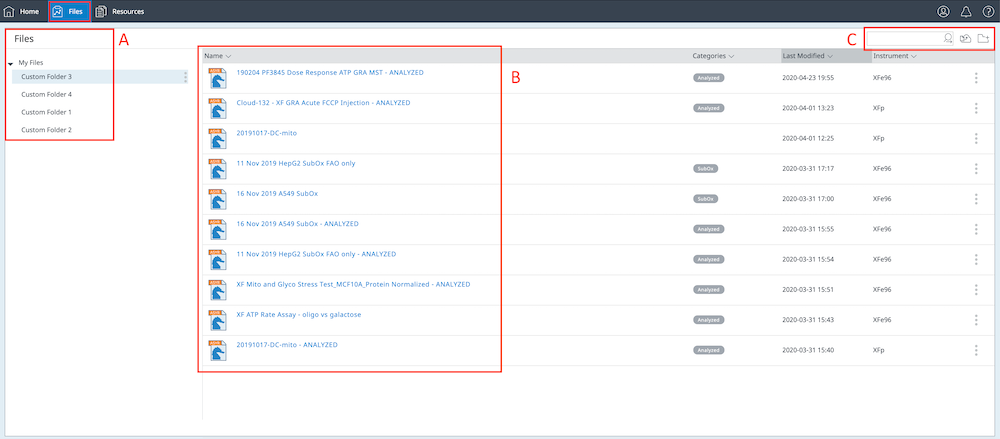
응용 상단의 진한 파란색 리본 왼쪽 상단에 있는 Files(파일) 버튼을 클릭하면 Seahorse Analytics 계정으로 가져온 모든 데이터 파일이 표시됩니다.
- Files(파일) 보기의 왼쪽에 계정에 대해 만든 사용자 지정 폴더가 표시됩니다.
- 파일 목록과 함께 제공되는 파일 메타 데이터(예: 마지막 수정 날짜, 기기 유형 등)는 Files(파일) 보기의 가운데에 표시됩니다.
- 파일 보기의 오른쪽 상단에 File Upload(파일 업로드) 버튼이 나타나고 데이터 파일을 내 계정으로 가져올 수 있습니다. Create Folder(폴더 생성하기) 버튼을 클릭하면 데이터 파일을 할당할 수 있는 새 사용자 지정 폴더를 생성할 수 있습니다. 또한 계정에 있는 데이터 파일의 키워드를 검색할 수 있는 search(검색) 필드도 있습니다. 검색 기능은 파일 이름, 카테고리, 마지막 수정 날짜, 기기 유형에서 일치하는 키워드를 찾습니다.
리소스 보기:
상단 진한 파란색 리본의 Resources(리소스)를 클릭하면 Agilent Seahorse XF 어세이 워크플로를 지원하는 데 자주 사용되는 리소스 모음과 Agilent 세포 분석 지원 팀의 연락처 정보를 사용할 수 있습니다.

설정 및 사용자 정보:
진한 파란색 상단 탐색 표시줄의 오른쪽 상단에 있는 작은 user account(사용자 계정) 아이콘을 클릭하여 사용자 계정 정보를 관리하거나 로그아웃합니다.
Settings and User Data(설정 및 사용자 데이터) 링크를 클릭하면 다음과 같은 계정 관리 옵션이 표시됩니다.
- 데이터 파일을 저장할 여유 공간을 확인하고, 애질런트 개인정보 보호정책을 확인하거나, Seahorse Analytics 계정을 삭제합니다.
- 사용자 지정 분석 보기의 이름을 바꾸거나 삭제합니다.
- Seahorse Analytics 계정 비밀번호를 변경합니다.
알림:
진한 파란색 상단 탐색 모음의 오른쪽 상단에 있는 작은 bell icon(종 아이콘)을 클릭하면 계정 알림이 표시됩니다. 알림은 다른 사람이 내게 데이터 파일을 공유했거나 내가 다른 사용자와 공유한 파일이 승인되었을 경우를 알려줍니다. 알림 종 아이콘에는 보류 중인 알림 수에 해당하는 작은 빨간색 숫자가 표시됩니다. 데이터 파일을 공유하고 수락하는 방법에 대한 자세한 내용은 Sharing(공유) 섹션을 참조하세요.
도움말:
진한 파란색 상단 탐색 표시줄의 오른쪽 상단에 있는 question mark(물음표 아이콘)을 클릭하면 기본 도움말 정보가 표시됩니다. 표시되는 도움말 정보는 도움말 버튼을 클릭할 때 소프트웨어의 현재 화면에 따라 달라집니다. 분석 보기에 대한 자세한 내용을 보려면 분석 보기에서 Help(도움말) 버튼을 클릭합니다. 파일 관리 기능에 대한 자세한 내용을 보려면 파일 보기에서 Help(도움말) 버튼을 클릭합니다.
데이터 파일을 가져오는 방법
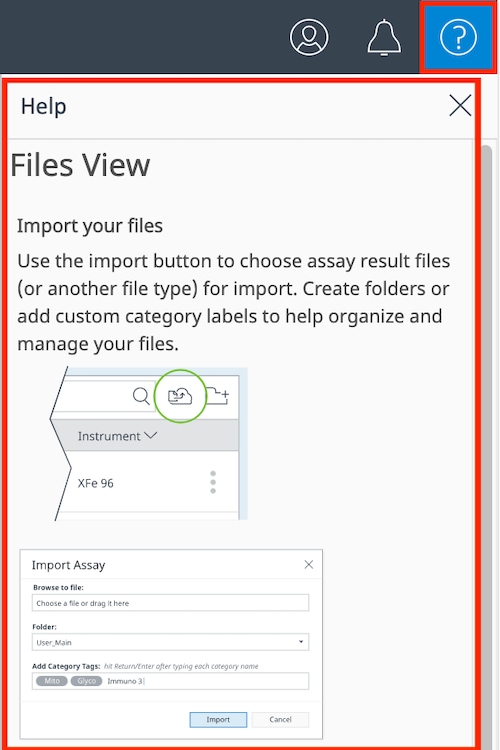
데이터 파일을 자신의 계정으로 가져오는 방법에는 두 가지가 있습니다. (1) 데이터 파일을 수동으로 가져오거나 (2) 공유된 데이터 파일을 수락하는 것입니다. Home(홈) 보기와 Files(파일) 보기 모두에서 두 보기의 파일 목록 위 오른쪽 상단에 있는 File Upload(파일 업로드) 버튼을 사용하여 데이터 파일을 내 계정으로 가져올 수 있습니다.
- File Upload(파일 업로드) 버튼을 클릭하면 파일 업로드 대화 상자(오른쪽 그림)가 표시됩니다.
- Choose a file(파일 선택) 텍스트를 클릭하여 데이터 파일을 찾아보거나 파일 탐색기가 데이터 파일에 열려 있는 경우 이 영역으로 파일을 끌어다 놓을 수 있습니다.
- 한 번에 하나 이상의 데이터 파일을 가져오면 2개의 데이터 파일이 가져오기를 위해 선택되었음을 확인할 수 있습니다.
- 기본 파일 목록 대신 데이터 파일을 저장할 사용자 지정 폴더를 선택합니다. 데이터 파일을 가져온 후에는 언제든지 사용자 지정 폴더로 이동할 수 있습니다.
- 새 카테고리를 입력하거나 카테고리 필드를 클릭하여 기존 카테고리 레이블을 표시하여 데이터 파일에 카테고리 레이블을 할당합니다.
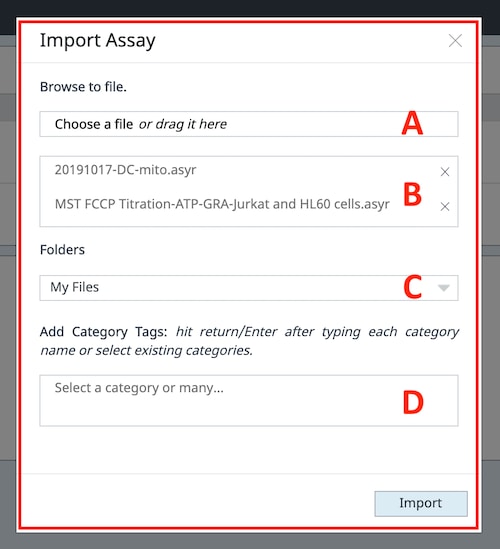
- Import(가져오기) 클릭
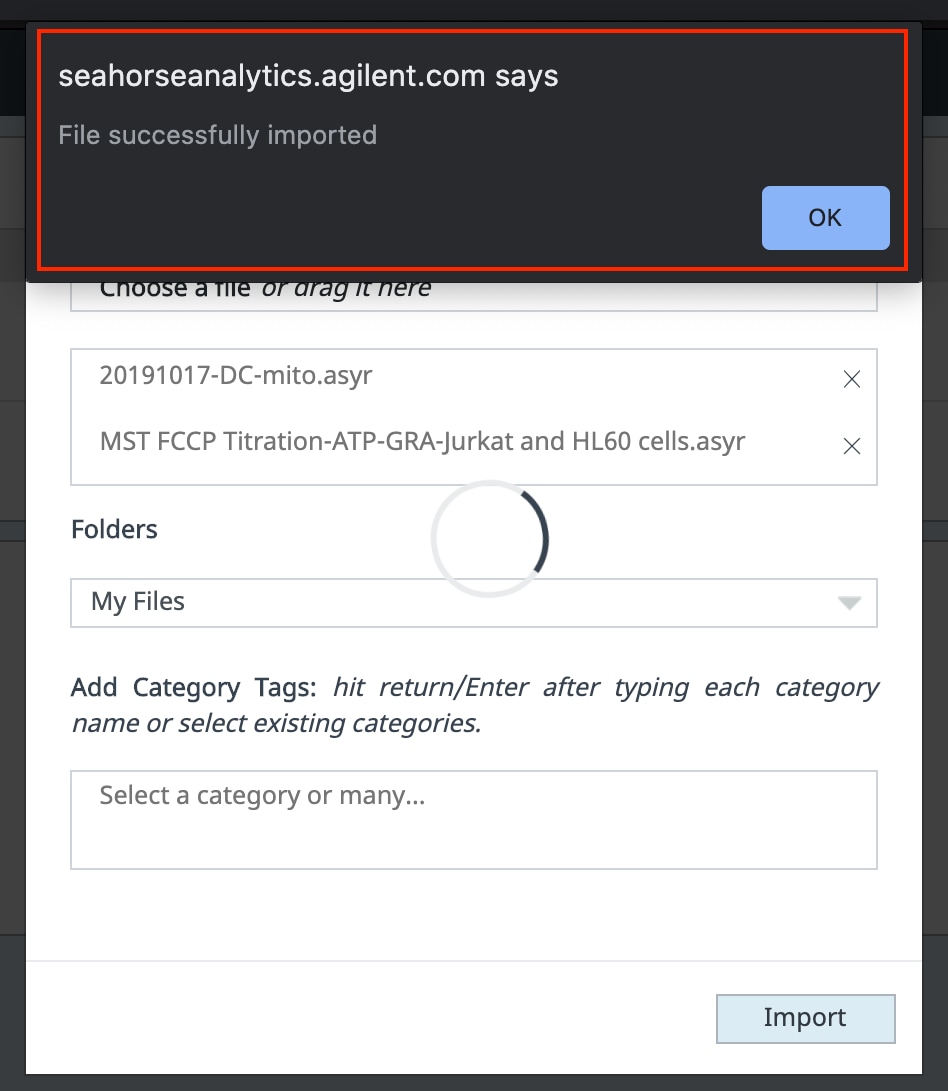
- Seahorse Analytics는 성공적인 파일 가져오기를 확인합니다. 이 대화 상자를 닫으면 가져온 파일이 파일 목록에 먼저 표시되는 것을 볼 수 있습니다.
기타 파일 관리 기능:
계정의 각 파일 오른쪽에 작은 점 3개 아이콘이 표시됩니다(아래 그림 참조).
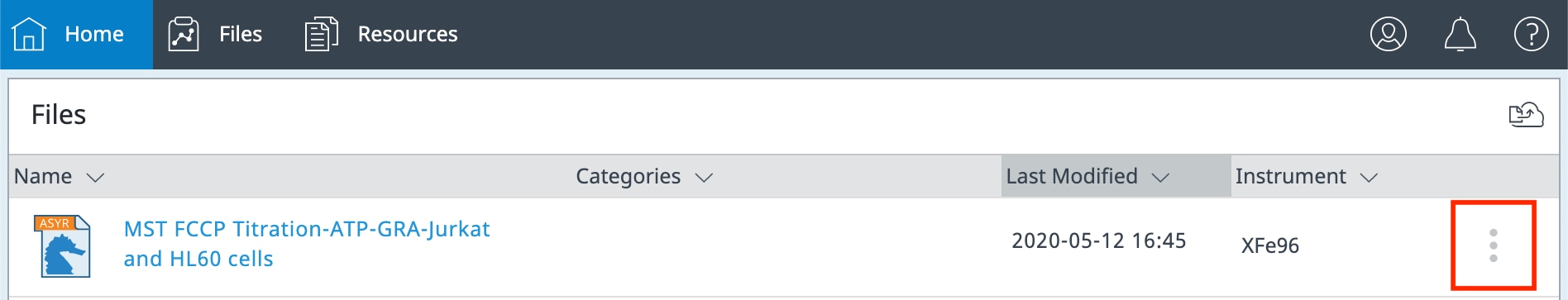
이 점 3개 버튼을 클릭하면 다음과 같은 추가 파일 기능 메뉴가 표시됩니다.
- 보내기: 선택한 파일을 보낼 이메일 주소를 입력할 수 있는 공유 대화 상자를 표시합니다.
- 삭제: 사용자 계정에서 선택한 파일을 삭제합니다.
- 카테고리: 카테고리 레이블을 추가하거나 삭제합니다.
- 사본 만들기: 선택한 파일의 복사본을 만듭니다.
- 이름 변경: 선택한 파일의 이름을 바꿉니다.
- 폴더로 이동: 선택한 파일을 사용자 지정 폴더로 이동합니다.
- Excel 및 GraphPad Prism으로 내보내기: 선택한 어세이 결과 파일의 데이터를 Microsoft Excel 또는 GraphPad Prism 파일로 내보냅니다.
- 다운로드: 선택한 파일을 PC에 다운로드합니다.
5.2 분석 보기
Seahorse Analytics 분석 보기는 단일 페이지에 있는 위젯(그래프)의 모음입니다. 분석 보기에는 표준 분석 보기, 사용자 지정 분석 보기, 어세이 키트 컴패니언 분석 보기의 세 가지 카테고리가 있습니다.
- 표준 분석 보기에는 특정 속도 측정 또는 일련의 속도 측정(예: 키네틱 그래프)에 대한 OCR, ECAR, PER를 보는 데 사용되는 키네틱 그래프, 산포도 및 막대 차트와 같은 기본 위젯 옵션이 포함되어 있습니다.
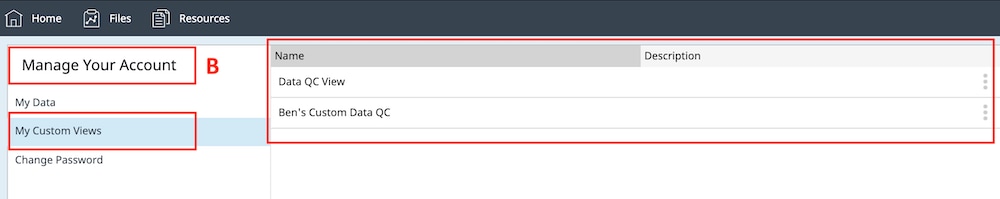
- 사용자 지정 분석 보기 목록에는 사용자가 선택한 정의된 위젯이 포함된 모든 사용자 지정 분석 보기가 표시됩니다. 모든 유형의 위젯을 사용자 지정 분석 보기에 추가할 수 있습니다.
- 어세이 키트 컴패니언 분석 보기 목록에는 각 보기의 위젯이 선택한 Agilent Seahorse XF 어세이 키트의 정의된 파라미터를 나타내는 분석 보기가 표시됩니다. 어세이 키트 컴패니언 분석 보기는 지원되는 각 Agilent Seahorse XF 어세이 워크플로 및 프로토콜을 사용하여 생성된 파일의 데이터 분석에 사용할 수 있습니다.
보기 목록을 확대하여 어세이 결과 파일에 적용된 분석 보기 목록을 표시하거나 새로운 분석 보기를 추가할 수 있습니다(아래 그림 참조).
기타 중요한 사항:
- Seahorse Analytics를 사용하여 모든 XF 어세이 워크플로를 분석할 수 있는 것은 아닙니다. 사용자 지정 분석 요구에 따라 결과 데이터를 Microsoft Excel 또는 GraphPad Prism으로 내보낼 수 있습니다.
- 각 위젯에는 해당 위젯의 그래프화된 데이터를 제어하는 자체 플레이트 맵이 있습니다. 그래프화된 데이터를 편집하려면 위젯을 더블 클릭하여 위젯 편집기 보기를 엽니다. 그래프 위의 리본에 표시된 함수와 그래프 오른쪽에 있는 플레이트 맵을 사용하여 그래프화된 데이터를 제어할 수 있습니다. 파일 수준에서 변경하려면 Modify(수정) 보기로 이동합니다.
- 어세이 결과 파일을 약간 수정하고 싶을 때가 있습니다. 리본의 오른쪽 상단에 있는 Modify(수정) 버튼을 클릭하면 모든 분석 보기에서 수정 기능에 액세스할 수 있습니다. Modify(수정)을 사용하여 파일을 변경하면 결과 파일의 모든 위젯/분석 보기에 영향을 미칩니다(예: 이상치 웰 제거, 그룹 색상 변경 또는 그룹 이름 변경).
블랭크 및 사용자 지정 분석 보기: 사용자 지정 분석 보기 기능은 최고의 데이터 분석 유연성을 제공합니다. 모든 분석 보기를 사용자 지정 보기로 저장할 수 있지만, 이 예에서는 블랭크 보기에서 시작하여 사용자 지정 분석 보기를 만드는 방법을 보여 줍니다. 아래의 일련의 단계에서는 블랭크 보기/사용자 지정 보기 기능을 사용하여 분석 워크플로의 일상적인 단계를 자동화하여 워크플로 일관성을 개선하고 시간을 절약하는 방법도 중점적으로 설명합니다.
a. 어세이 결과 파일을 열고 Standard Graphs(표준 그래프) > Blank View(블랭크 보기)를 선택한 후 Add View(보기 추가)를 클릭합니다
b. Add Widget(위젯 추가)를 클릭하고 Standard Graphs(표준 그래프) > Kinetic Graph(키네틱 그래프)를 선택한 후 Add Widget(위젯 추가)를 클릭합니다
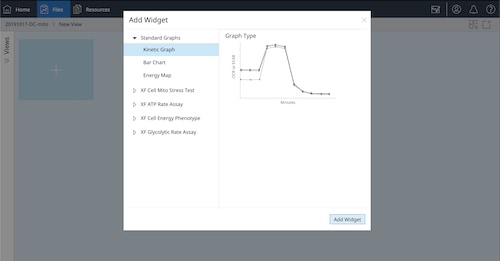
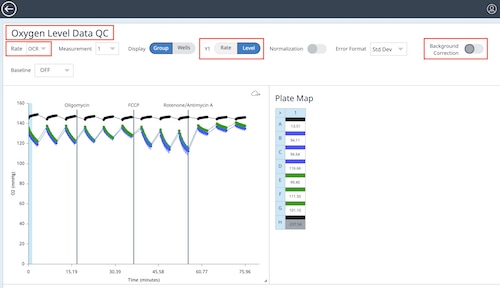
c. Widget Editor(위젯 편집기) 보기에서 다음 단계를 수행합니다.
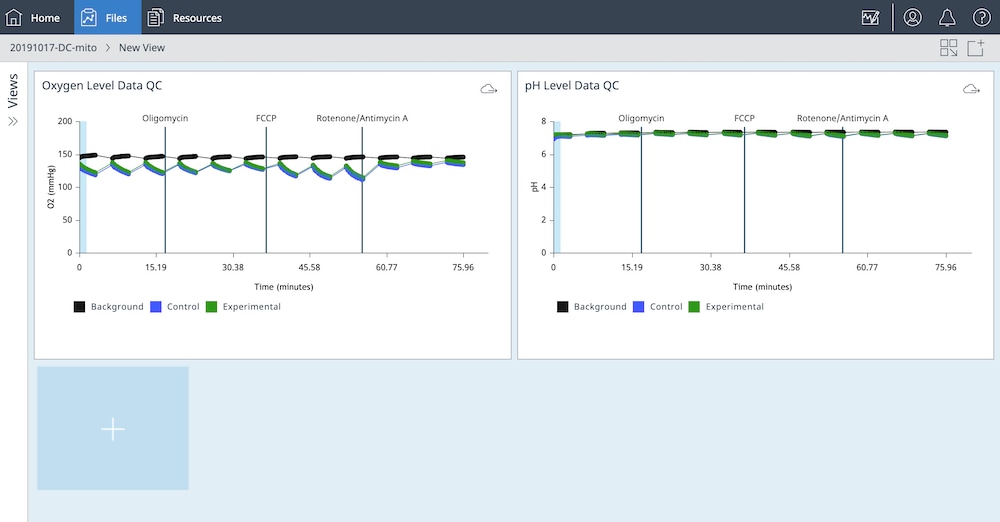
- Y1 > 레벨을 전환하여 O2 레벨 데이터를 표시합니다
- 백그라운드 보정을 끕니다
- 위젯의 이름을 두 번 클릭하고 산소 레벨 데이터 QC를 입력합니다
d. 뒤로 가기 화살표를 클릭하여 분석 보기로 돌아갑니다.
e. Add Widget(위젯 추가) +(키네틱 그래프 아래 그림)를 클릭하고 Standard Graphs(표준 그래프) > Kinetic Graph(키네틱 그래프)를 선택한 다음 Add Widget(위젯 추가)를 클릭합니다
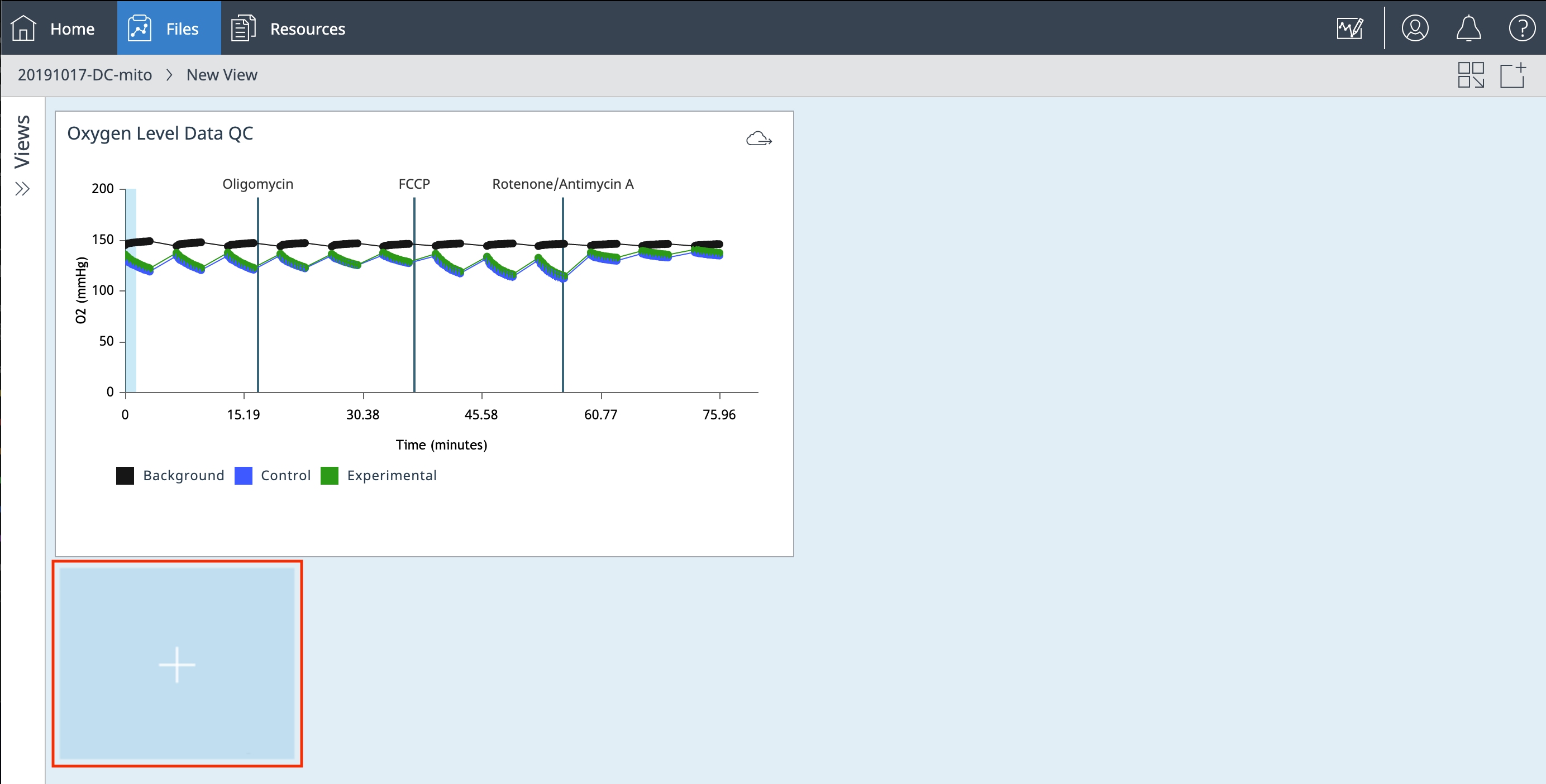
f. Widget Editor(위젯 편집기) 보기에서 다음 단계를 수행합니다.
- Rate(속도) 드롭다운 메뉴를 사용하여 ECAR를 선택합니다
- Y1 > 레벨을 전환하여 pH 레벨 데이터를 표시합니다
- 백그라운드 보정을 끕니다
- 위젯 이름을 두 번 클릭하고 pH 레벨 데이터 QC를 입력합니다
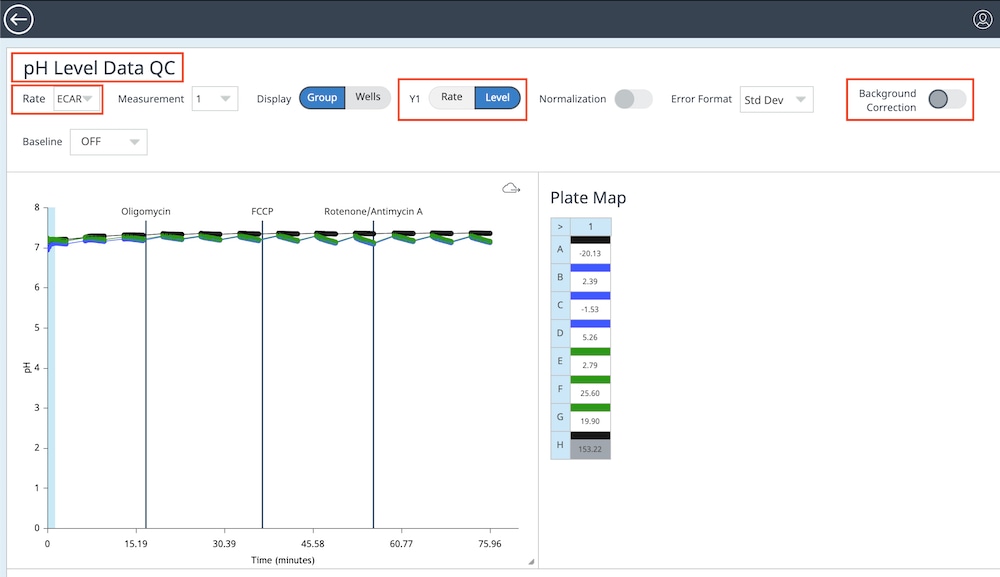
g. back-arrow(뒤로 가기 화살표)를 클릭하여 분석 보기로 돌아갑니다.
h. 분석 보기의 오른쪽에 있는 Views(보기) 메뉴를 확장하고 "새로운 보기" 분석 보기 이름 오른쪽에 있는 그림과 같은 3-dot(점 3개) 버튼을 클릭합니다.
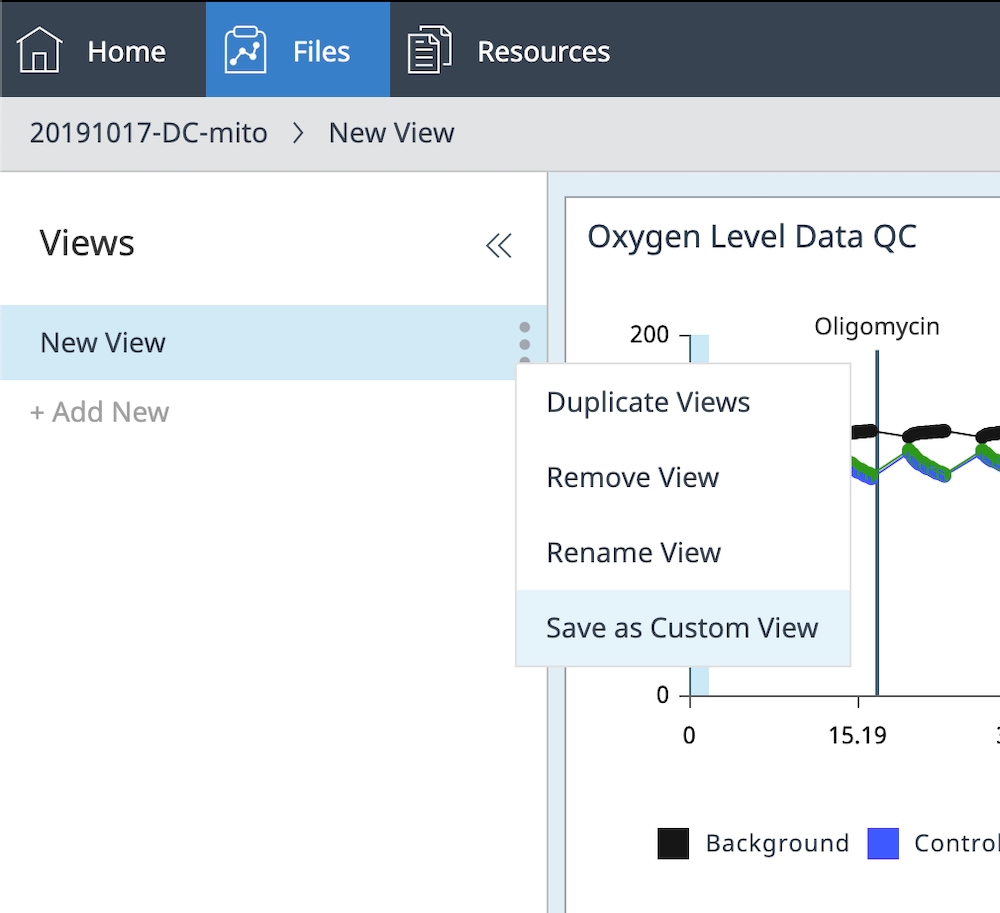
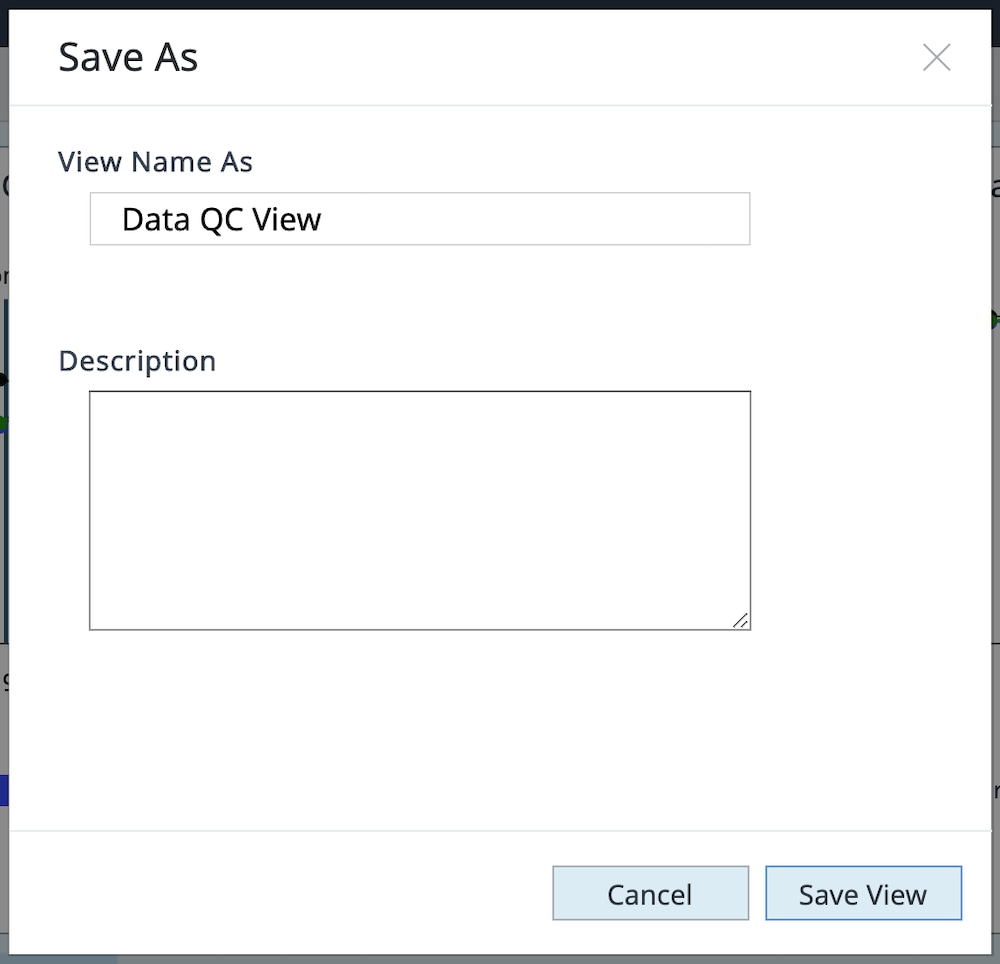
i. Save as Custom View(사용자 지정 보기로 저장)를 클릭하고 사용자 지정 보기 이름(예: 데이터 QC 보기)을 입력합니다.
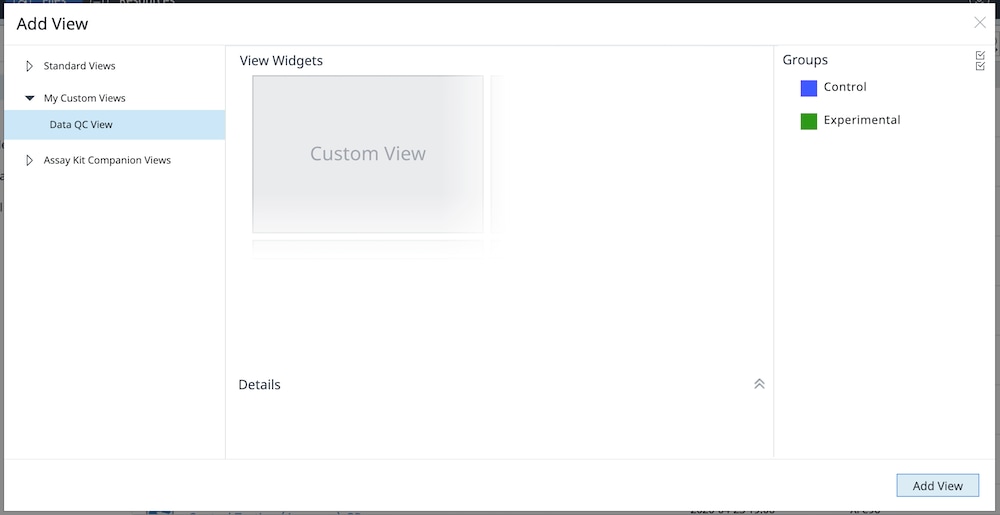
j. 다음에 분석을 위해 데이터 파일을 가져올 때 사용자 지정 데이터 QC 보기를 선택할 수 있으므로 새로 가져오는 모든 파일에 대해 동일한 분석 파일을 만드는 시간을 절약할 수 있습니다.
어세이 키트 컴패니언 분석 보기 정보:
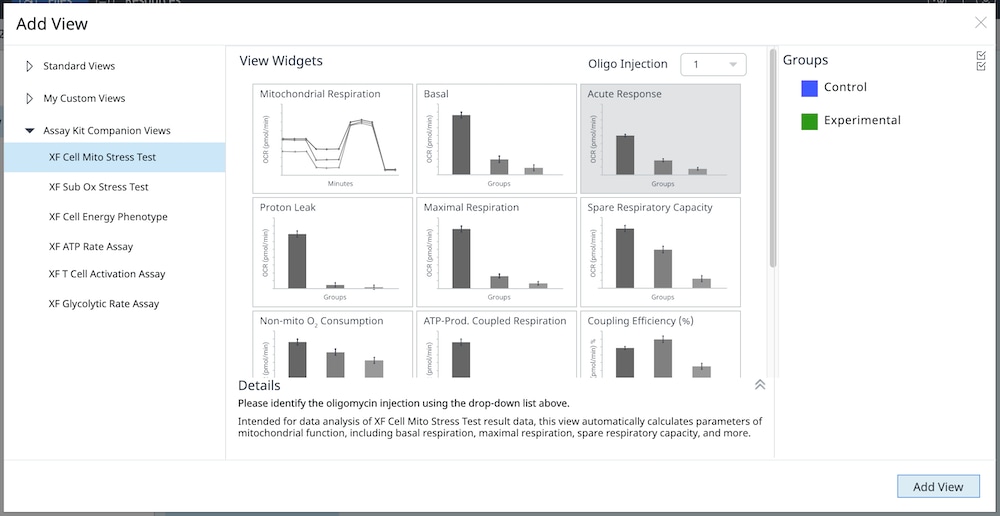
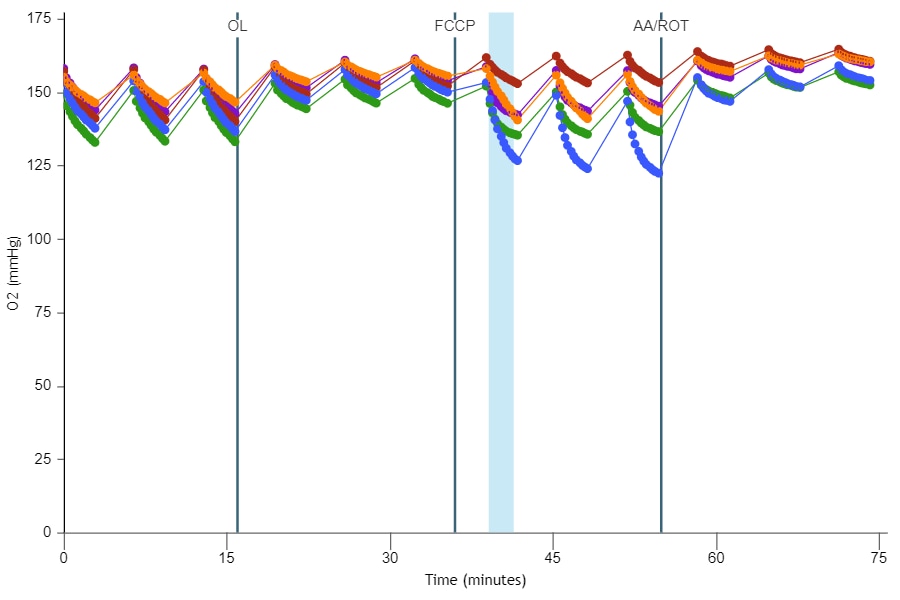
1. Assay Kit Companion Analysis View(어세이 키트 컴패니언 분석 보기) » XF Cell Mito Stress Test(XF 세포 미토콘드리아 스트레스 측정): 단일 분석 보기에서 XF 세포 미토콘드리아 스트레스 측정 어세이 파라미터를 계산하고 표시하려면:
- Add View(보기 추가) 창에서 Assay Kit Companion View(어세이 키트 관련 보기) 목록을 클릭하여 옵션 목록을 확장합니다.
- XF Cell Mito Stress Test(XF 세포 미토콘드리아 스트레스 측정) 실험 보기를 클릭하여 어세이 파라미터 위젯을 표시합니다.
- 중요: 4회 주입이 포함된 XF 세포 미토콘드리아 스트레스 측정 어세이의 경우 이 분석 보기를 추가하기 전에 위젯 위에 표시된 드롭다운 메뉴를 사용하여 oligomycin 주입을 식별해야 합니다. 이 oligomycin 주입 선택은 어세이 파라미터를 정확하게 계산하는 데 중요한 역할을 하며, 정확하지 않은 oligomycin 주입을 선택하면 위젯 계산과 그래프가 정확하지 않게 됩니다.
- 원하는 파라미터 위젯(예: 기초 호흡 능력, 최대 호흡 능력 등)을 선택하여 분석 보기에 추가합니다. 위젯 주위의 파란색 윤곽선은 해당 위젯이 선택되었음을 나타냅니다. 급성 반응 위젯이 회색으로 표시된 경우, 이 파라미터는 급성 주입을 사용하는 XF 세포 미토콘트리아 스트레스 측정 실험에 대해서만 계산할 수 있으므로 선택할 수 없습니다.
- 필요한 경우 group list(그룹 목록)에서 그룹을 끄고/켜고 Add View(보기 추가)를 클릭합니다.
또한 기존 분석 보기에 개별 XF 세포 미토콘드리아 스트레스 측정 어세이 파라미터 위젯(예: 예비 호흡 능력)을 추가할 수도 있습니다.
a. Add Widget(위젯 추가) 버튼(오른쪽에 빨간색 윤곽선으로 표시)을 클릭합니다.
b. XF 세포 미토콘드리아 스트레스 측정 어세이 위젯 목록을 확장하고 원하는 위젯을 선택한 후 Add Widget(위젯 추가)를 클릭합니다.
중요: 4회 주입이 포함된 XF 세포 미토콘드리아 스트레스 측정 어세이의 경우 선택한 위젯을 분석 보기에 추가하기 전에 위젯 위에 표시된 드롭다운 메뉴를 사용하여 oligomycin 주입을 식별해야 합니다. 이 oligomycin 주입 선택은 어세이 파라미터를 정확하게 계산하는 데 중요한 역할을 하며, 정확하지 않은 oligomycin 주입을 선택하면 위젯 계산과 그래프가 정확하지 않게 됩니다.
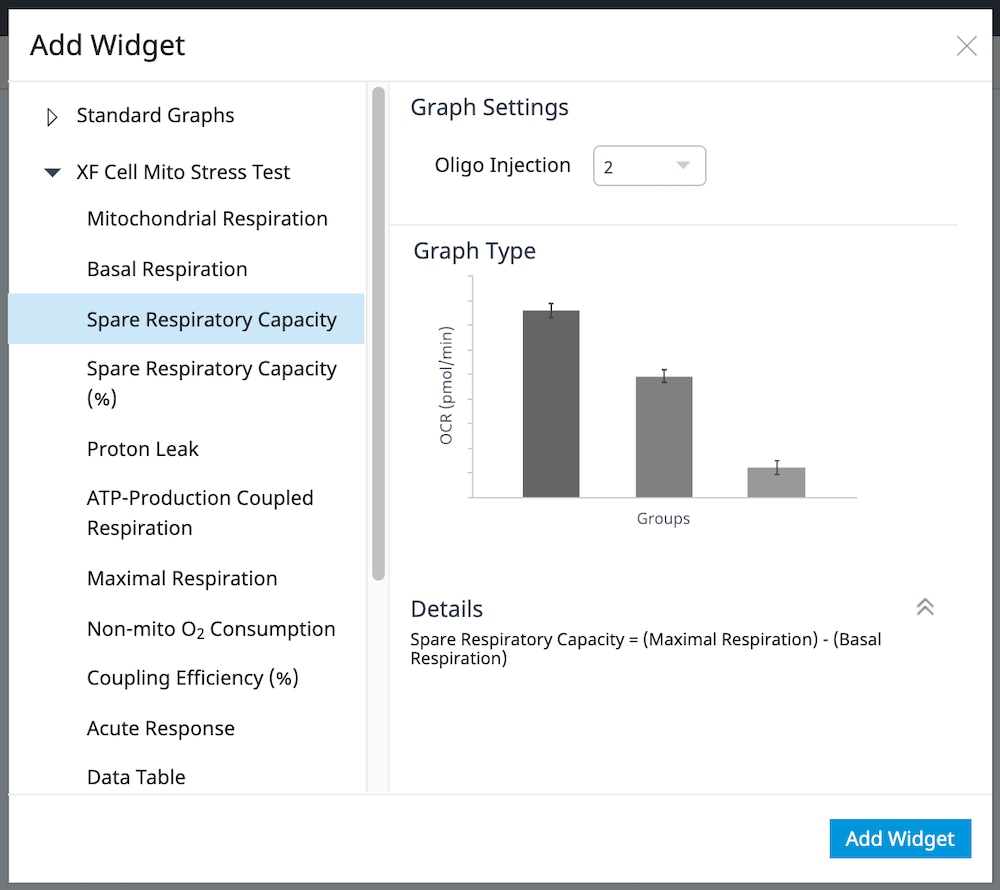
아래 표는 XF 세포 미토콘드리아 스트레스 측정 어세이 파라미터 계산에 대해 설명합니다.
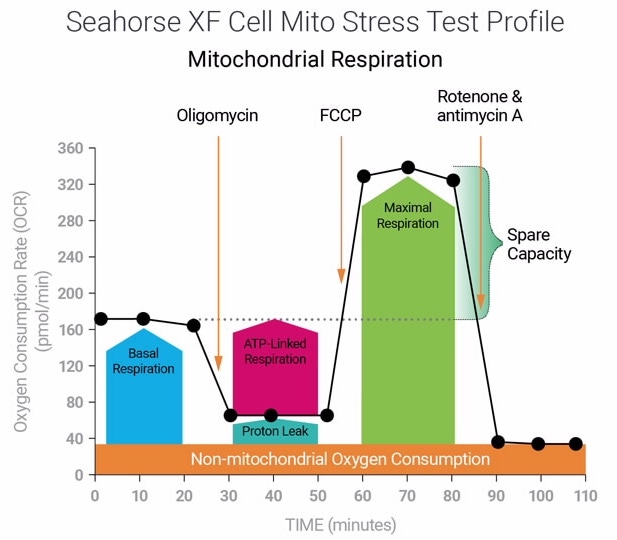
| 어세이 파라미터 | 수식 |
|---|---|
| 비미토콘드리아성 산소 소비량 | Rotenone/antimycin A 주입 후 최소 속도 측정 |
| 기초 호흡 능력 | (첫 번째 주입 전 마지막 속도 측정) - (비미토콘드리아성 산소 소비량) |
| 최대 호흡 능력 | (FCCP 주입 후 최대 속도 측정) – (비미토콘드리아성 산소 소비량) |
| 양성자 누수 | (Oligomycin 주입 후 최소 속도 측정) – (비미토콘드리아성 산소 소비량) |
| ATP-생성 관련 호흡 | (Oligomycin 주입 전 마지막 속도 측정) – (Oligomycin 주입 후 최소 속도 측정) |
| 예비 호흡 능력 | (최대 호흡 능력) – (기초 호흡 능력) |
| 예비 호흡 능력(%) | (최대 호흡 능력)/(기초 호흡 능력) × 100% |
| 급성 반응 | (Oligomycin 주입 전 마지막 속도 측정) – (급성 주입 전 마지막 속도 측정) |
| 결합 효율 | (ATP-생성 관련 호흡)/(기초 호흡 능력) × 100% |
2. Assay Kit Companion Analysis View(어세이 키트 컴패니언 분석 보기) » XF Substrate Oxidation Stress Test: 단일 분석 보기에서 XF Substrate Oxidation Stress Test 어세이 파라미터를 계산하고 표시하려면:
- Add View(보기 추가) 창에서 Assay Kit Companion View(어세이 키트 관련 보기) 목록을 클릭하여 옵션 목록을 확장합니다.
- XF Sub Ox Stress Test 분석 보기를 클릭하여 어세이 파라미터 위젯을 표시합니다.
- 분석 보기에 추가할 원하는 파라미터 위젯을 선택합니다. 위젯 주위의 파란색 윤곽선은 해당 위젯이 선택되었음을 나타냅니다.
- 선택 사항: FCCP 최대 속도 드롭다운을 사용하면 최대 호흡 능력 계산에 사용할 FCCP 주입 후 측정 지점을 선택할 수 있습니다. 기본 옵션을 사용하면 Seahorse Analytics는 그룹별로 최대 호흡 능력을 계산하고; 최대 반응은 그룹마다 다를 수 있습니다(즉, 그룹 1 최대 반응은 FCCP 주입 후 첫 번째 측정이고 그룹 2 최대 반응은 FCCP 주입 후 세 번째 속도 측정임).
최대 호흡 능력 계산을 위해 특정 속도 측정을 선택할 수도 있으며 Seahorse Analytics는 각 그룹에 대해 동일한 FCCP 이후 주입 속도 측정을 사용합니다. 위의 예를 사용하면 Seahorse Analytics가 그룹 내 최대 호흡 능력을 계산하는 대신 특정 FCCP 이후 주입 속도 측정을 사용하여 모든 그룹에 대한 최대 반응을 계산하도록 지시할 수 있습니다. - 필요한 경우 group list(그룹 목록)에서 그룹을 끄고/켜고 Add View(보기 추가)를 클릭합니다.

또한 기존 분석 보기에 개별 XF Substrate Oxidation Stress Test 어세이 파라미터 위젯(예: 최대 호흡 능력)을 추가할 수도 있습니다.
a. Add Widget(위젯 추가) 버튼(오른쪽에 빨간색 윤곽선으로 표시)을 클릭합니다.

b. XF Sub Ox Stress Test 위젯 목록을 확장하고 원하는 위젯을 선택한 후 Add Widget(위젯 추가)을 클릭합니다.
아래 표는 XF Substrate Oxidation Stress Test 어세이 파라미터 계산에 대해 설명합니다.
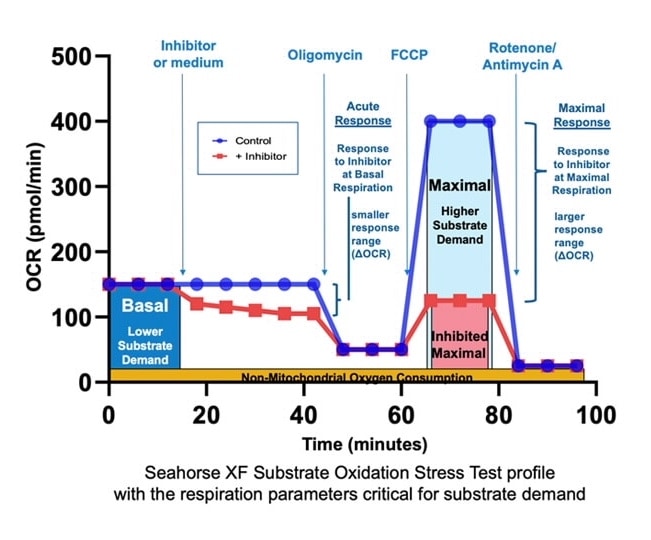
| 어세이 파라미터 | 수식 |
|---|---|
| 기초 호흡 능력 | (첫 번째 주입 전 마지막 속도 측정) – (비미토콘드리아성 산소 소비량*) |
| 최대 호흡 능력 | (FCCP 주입 후 최대 속도 측정) – (비미토콘드리아성 산소 소비량*) |
| 급성 반응 | (Oligomycin 주입 전 마지막 속도 측정) – (급성 주입 전 마지막 속도 측정) |
| * 비미토콘드리아성 산소 소비량 | Rotenone/antimycin A 주입 후 최소 속도 측정 |
| 참고: Substrate Oxidation Stress Test 어세이 프로토콜은 급성 주입을 사용하는 XF 세포 미토콘드리아 스트레스 측정 어세이의 어세이 프로토콜과 동일하므로 Add Widget(위젯 추가) > XF Cell Mito Stress Test 위젯 목록에서 원하는 어세이 파라미터(예: 양성자 누수, ATP 연결 OCR, 예비 호흡 능력 및 비 미토콘드리아성 OCR 등)를 선택하여 XF Cell Mito Stress Test 데이터 파일에서 다른 XF Cell Mito Stress Test 어세이 파라미터를 도출할 수 있습니다. | |
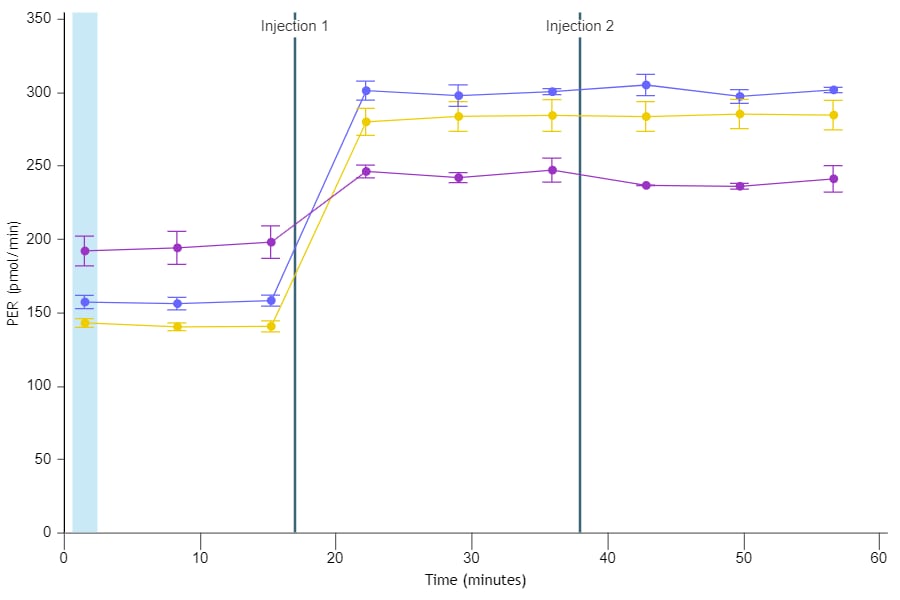
3. Assay Kit Companion Analysis View(어세이 키트 컴패니언 분석 보기) » XF Cell Energy Phenotype Test(XF 세포 에너지 표현형 테스트): 단일 분석 보기에서 XF 세포 에너지 표현형 테스트 어세이 파라미터를 계산하고 표시하려면:
- Add View(보기 추가) 창에서 Assay Kit Companion View(어세이 키트 관련 보기) 목록을 클릭하여 옵션 목록을 확장합니다.
- XF Cell Energy Phenotype(XF 세포 에너지 표현형 테스트) 분석 보기를 클릭하여 어세이 파라미터 위젯을 표시합니다.
- 분석 보기에 추가할 원하는 파라미터 위젯을 선택합니다. 위젯 주위의 파란색 윤곽선은 해당 위젯이 선택되었음을 나타냅니다.
- 필요한 경우 group list(그룹 목록)에서 그룹을 끄고/켜고 Add View(보기 추가)를 클릭합니다.
또한 기존 분석 보기에 개별 XF 세포 에너지 표현형 테스트 어세이 파라미터 위젯(예: 대사 잠재력)을 추가할 수도 있습니다.
a. Add Widget(위젯 추가) 버튼(오른쪽에 빨간색 윤곽선으로 표시)을 클릭합니다.

b. XF 세포 에너지 표현형 테스트를 확장하고 원하는 위젯을 선택한 후 Add Widget(위젯 추가)을 클릭합니다.

아래 표는 XF 세포 에너지 표현형 테스트 어세이 파라미터 계산에 대해 설명합니다.
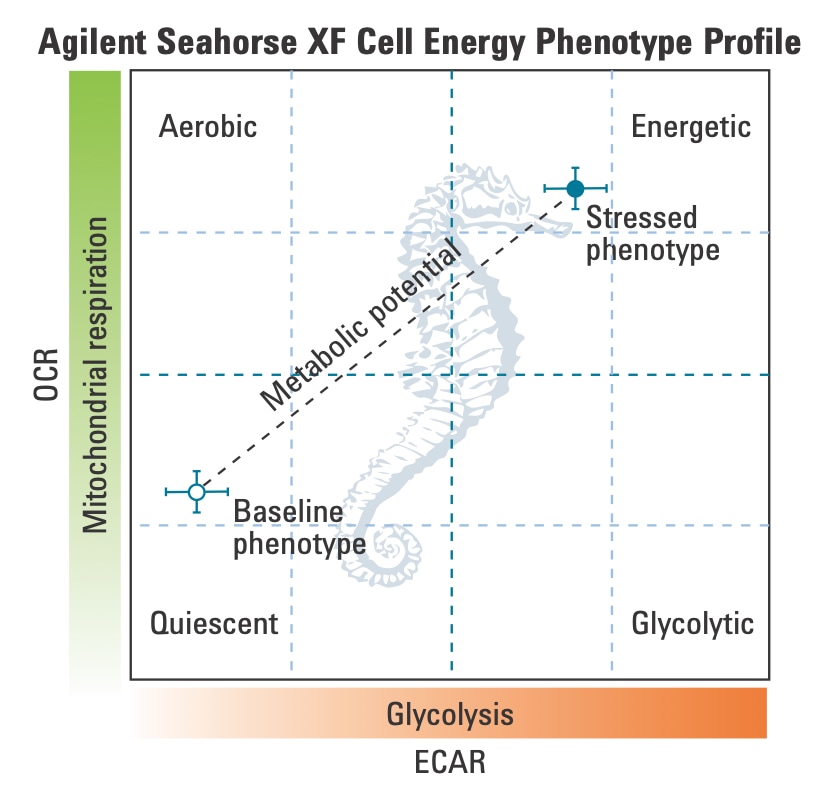
| 어세이 파라미터 | 수식 |
|---|---|
| 베이스라인 OCR | 첫 번째 주입 전 마지막 OCR 속도 측정 |
| 베이스라인 ECAR | 첫 번째 주입 전 마지막 ECAR 속도 측정 |
| 스트레스 OCR | 첫 번째 주입 후 최대 OCR 속도 측정 |
| 스트레스 ECAR | 첫 번째 주입 후 최대 ECAR 측정 |
| 대사적 잠재력(OCR) | (스트레스 OCR/베이스라인 OCR) × 100% |
| 대사적 잠재력(ECAR) | (스트레스 ECAR/베이스라인 ECAR) × 100% |
4.2. Assay Kit Companion Analysis View(어세이 키트 컴패니언 분석 보기) » XF Real-Time ATP Rate Assay(XF Real-Time ATP 생성률 어세이): 단일 분석 보기에서 XF Real-Time ATP 생성률 어세이 파라미터를 계산하고 표시하려면 다음 단계를 따릅니다. 이 분석 보기와 이 분석 보기의 위젯을 어세이 결과 파일에 추가하려면 buffer factor를 적합하게 구성해야 합니다.
- Add View(보기 추가) 창에서 Assay Kit Companion View(어세이 키트 관련 보기) 목록을 클릭하여 옵션 목록을 확장합니다.
- XF ATP 생성률 어세이 분석 보기를 클릭하여 어세이 파라미터 위젯을 표시합니다.
- 유도 XF ATP 생성률 어세이(oligomycin 및 rotenone/antimycin A의 표준 주입 전 1회 또는 2회 주입)의 경우, 이 분석 보기를 추가하려면 위젯 위에 표시된 드롭다운 메뉴를 사용하여 oligomycin 주입이 주입 2인지, 주입 3인지 식별해야 합니다. 이 oligomycin 주입 선택은 어세이 파라미터를 정확하게 계산하는 데 중요한 역할을 하며, 정확하지 않은 oligomycin 주입을 선택하면 위젯 계산 및 그래프가 정확하지 않게 됩니다. 이 두 워크플로에 대한 자세한 내용은 XF Real-Time ATP 생성률 어세이 사용 설명서를 참조하세요.
- 분석 보기에 추가할 원하는 파라미터 위젯을 선택합니다. 위젯 주위의 파란색 윤곽선은 해당 위젯이 선택되었음을 나타냅니다. 위젯이 회색으로 표시되면 어세이 파일에 파라미터를 계산하는 데 필요한 최소 주입 횟수가 없기 때문에 위젯을 선택할 수 없다는 의미입니다.
- 필요한 경우 group list(그룹 목록)에서 그룹을 끄고/켜고 Add View(보기 추가)를 클릭합니다.
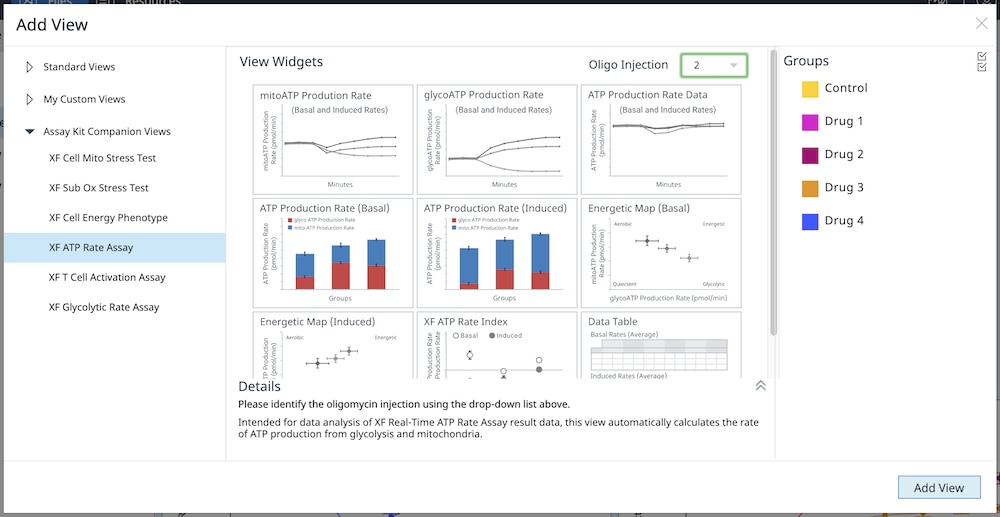
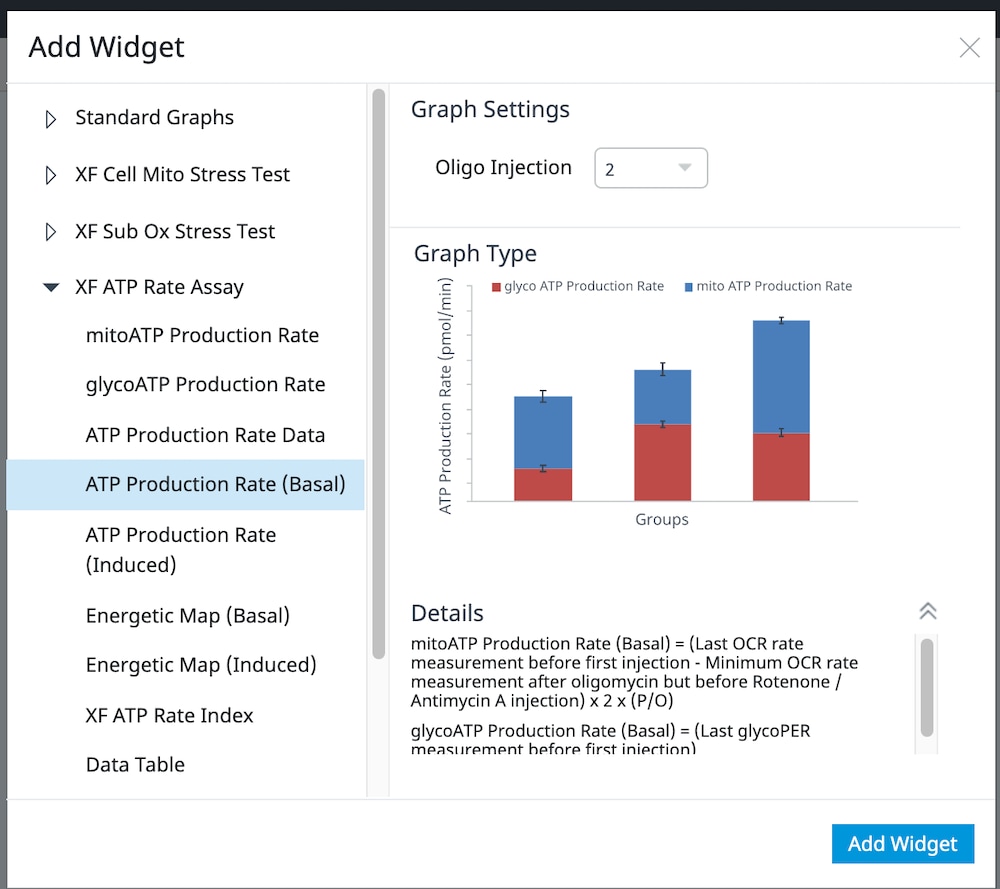
또한 기존 어세이 보기에 개별 XF ATP 속도 어세이 파라미터 위젯(예: ATP 기초 생성률)을 추가할 수도 있습니다.
a. Add Widget(위젯 추가) 버튼(오른쪽에 빨간색 윤곽선으로 표시)을 클릭합니다.

b. XF ATP Rate Assay widget list(XF ATP 생성률 어세이 위젯 목록)를 확장하고 원하는 위젯을 선택한 후 Add Widget(위젯 추가)을 클릭합니다.
중요: 유도 XF ATP 생성률 어세이(oligomycin 및 rotenone/antimycin A의 표준 주입 전 1회 또는 2회 주입)의 경우, 이 분석 보기를 추가하기 위해 위젯 위에 표시된 드롭다운 메뉴를 사용하여 oligomycin 주입이 주입 2인지 주입 3인지 확인해야 합니다. 이 oligomycin 주입 선택은 어세이 파라미터를 정확하게 계산하는 데 중요한 역할을 합니다. 정확하지 않은 Oligomycin 주입을 선택하면 위젯 계산과 그래프가 정확하지 않습니다.
아래 표는 표준 및 유도 어세이 워크플로 모두에 대한 XF Real-Time ATP 생성률 어세이 파라미터 계산을 설명합니다.
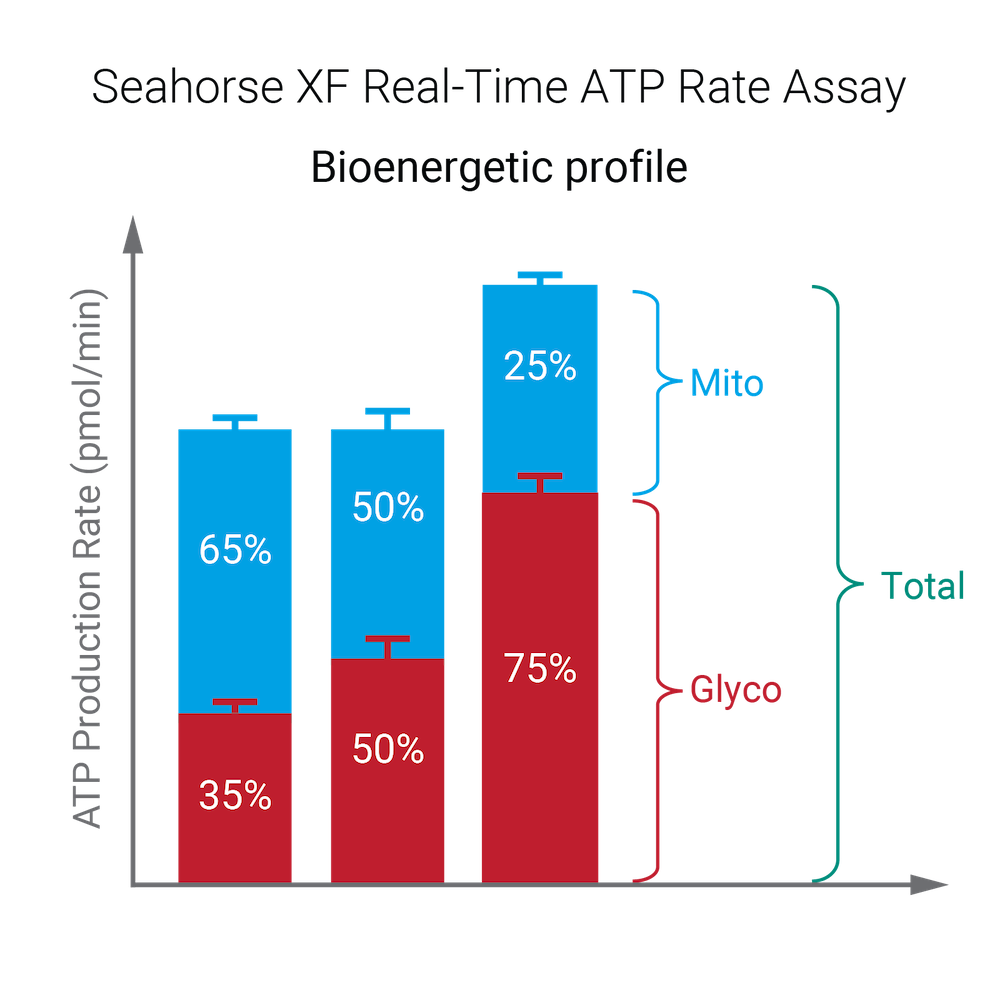
표준 XF Real-Time ATP 생성률 어세이
| 어세이 파라미터 | 수식 |
|---|---|
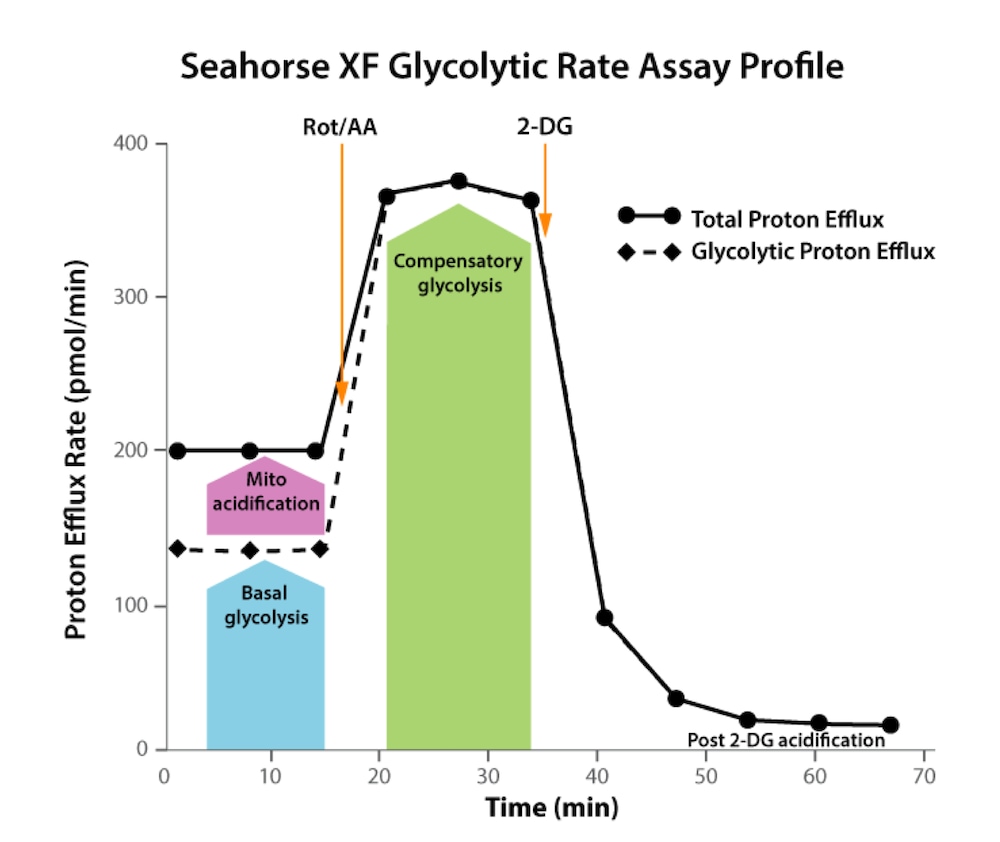
| mitoATP 생성률(기초) | [(첫 번째 주입 전 마지막 OCR 속도 측정 - oligomycin 후, Rot/AA 주입 전 최소 OCR 속도 측정) x 2 x (P/O)] |
| glycoATP 생성률(기초) | 첫 주입 전 마지막 glycoPER 측정 |
| 총 ATP 생성률(기초) | (mitoATP 생성률) + (glycoATP 생성률) |
| XF ATP 생성률 지수(기초) | (mitoATP 생성률) / (glycoATP 생성률) |
유도 XF Real-Time ATP 생성률 어세이:
| 어세이 파라미터 | 수식 |
|---|---|
| mitoATP 생성률(기초) | [(첫 번째 주입 전 마지막 OCR 속도 측정 - oligomycin 후, Rot/AA 주입 전 최소 OCR 속도 측정) x 2 x (P/O)] |
| glycoATP 생성률(기초) | 첫 주입 전 마지막 glycoPER 측정 |
| 총 ATP 생성률(기초) | (mitoATP 생성률) + (glycoATP 생성률) |
| XF ATP 생성률 지수(기초) | (mitoATP 생성률) / (glycoATP 생성률) |
| mitoATP 생성률(유도) | (급성 약물 주입 후, oligomycin 주입 전 평균 OCR 속도 측정) - (올리고 후 및 Rot/AA 주입 전 최소 OCR 속도 측정)] x 2 x (P/O) |
| glycoATP 생성률(유도) | 급성 약물 주입 후 및 다음 주입 전의 glycoATP 생성률 측정 평균. |
| 총 ATP 생성률(유도) | mitoATP 생성률(유도) + glycoATP 생성률(유도) |
| XF ATP 생성률 지수(유도) | mitoATP 생성률(유도) / glycoATP 생성률(유도) |
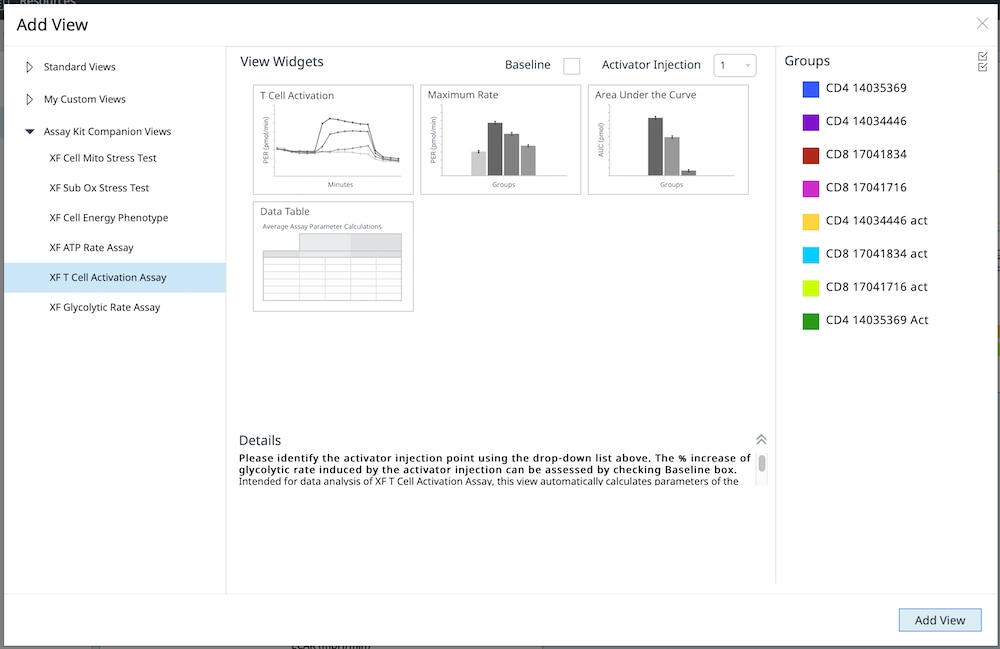
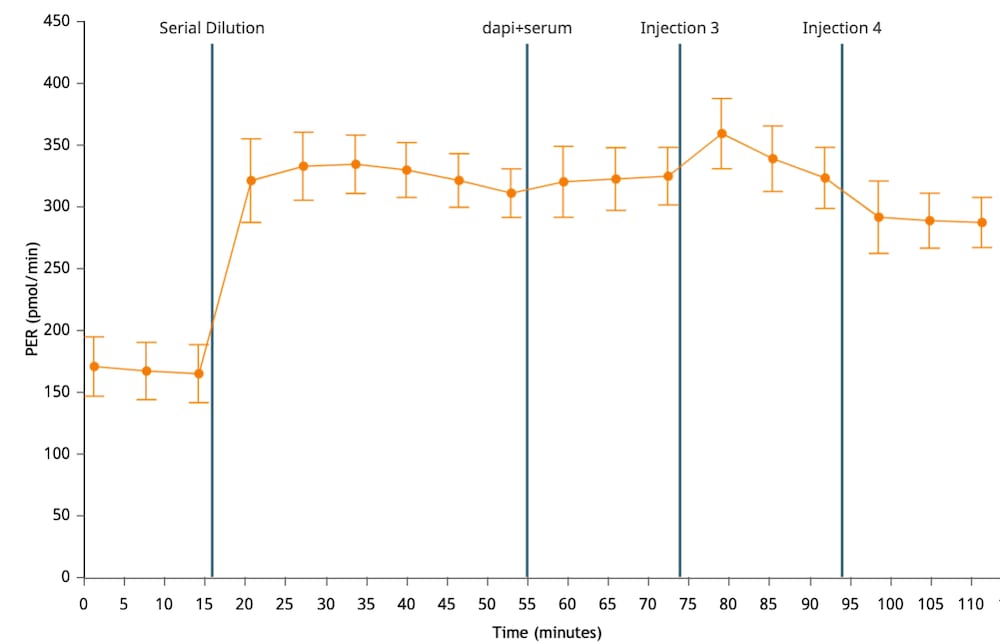
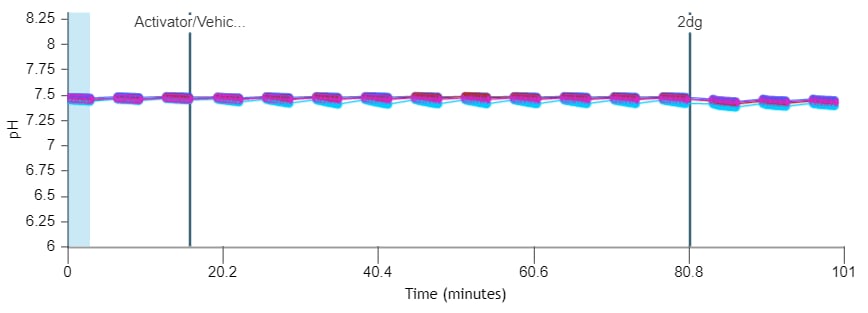
5.3. Assay Kit Companion Analysis View(어세이 키트 관련 분석 보기) » XF T Cell Activation Assay(XF T 세포 활성화 실험): 단일 분석 보기에서 XF T 세포 활성화 실험 파라미터를 계산하고 표시하려면:
- Add View(보기 추가) 창에서 Assay Kit Companion View(어세이 키트 관련 보기) 목록을 클릭하여 옵션 목록을 확장합니다.
- XF T Cell Activation Assay(XF T 세포 활성화 실험) 분석 보기를 클릭하여 어세이 파라미터 위젯을 표시합니다.
- Baseline(베이스라인) 확인란을 선택하여 각 위젯에 표시되는 PER 데이터를 활성제 주입 전 마지막 속도 측정인 베이스라인 속도 측정의 백분율(%)로 계산합니다. 정량적 데이터의 경우 Baseline(베이스라인) 확인란을 선택하지 않은 상태로 두어 (pmol/분) 단위로 PER을 계산합니다.
- Activator Injection(활성제 주입) 드롭다운 메뉴에서 정확한 주입 위치가 선택되었는지 확인합니다.
- 분석 보기에 추가할 원하는 파라미터 위젯을 선택합니다. 위젯 주위의 파란색 윤곽선은 해당 위젯이 선택되었음을 나타냅니다.
- 필요한 경우 group list(그룹 목록)에서 그룹을 끄고/켜고 Add View(보기 추가)를 클릭합니다.
또한 기존 분석 보기에 개별 XF T 세포 활성화 실험 파라미터 위젯(예: 최대 속도)을 추가할 수도 있습니다.
c. Add Widget(위젯 추가) 버튼을 클릭합니다(오른쪽에 빨간색 윤곽선으로 표시).

d. XF T 세포 활성화 실험을 확장하고 원하는 위젯을 선택한 후 Add Widget(위젯 추가)을 클릭합니다.
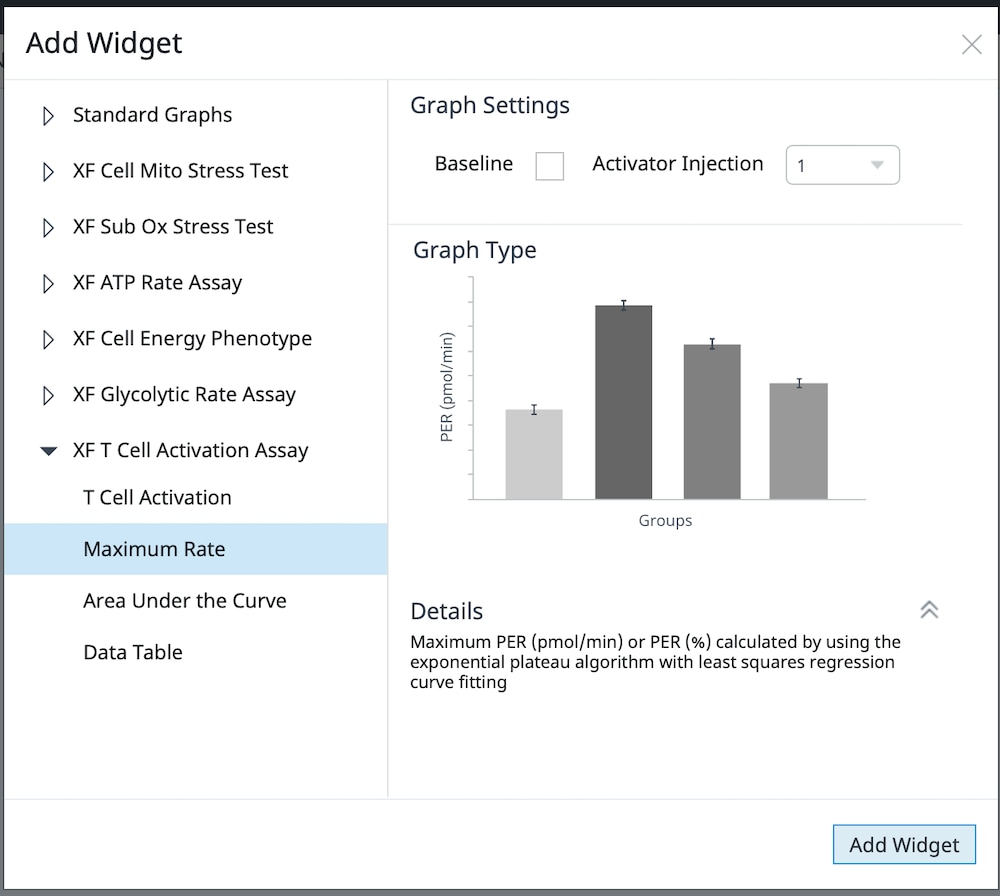
아래 표는 XF T 세포 활성화 실험 파라미터 계산을 설명합니다.
| 어세이 파라미터 | 수식 |
|---|---|
| T 세포 활성화 | 키네틱 그래프로 표시한 양성자 유출율(PER) 데이터 |
| 최대 속도 | 활성제 주입 후와 2-DG 주입 전의 속도 측정 데이터를 사용하는 비선형 최소 제곱 곡선 피팅 알고리즘으로 Seahorse Analytics에서 계산됩니다. 이 계산 분석법에 대한 자세한 내용은 다음을 참조하세요. H. J. Motulsky, "Exponential plateau", GraphPad Curve Fitting Guide. Accessed 20 May 2020. https://www.graphpad.com/guides/prism/8/curve-fitting/REG_Exponential-plateau.htm 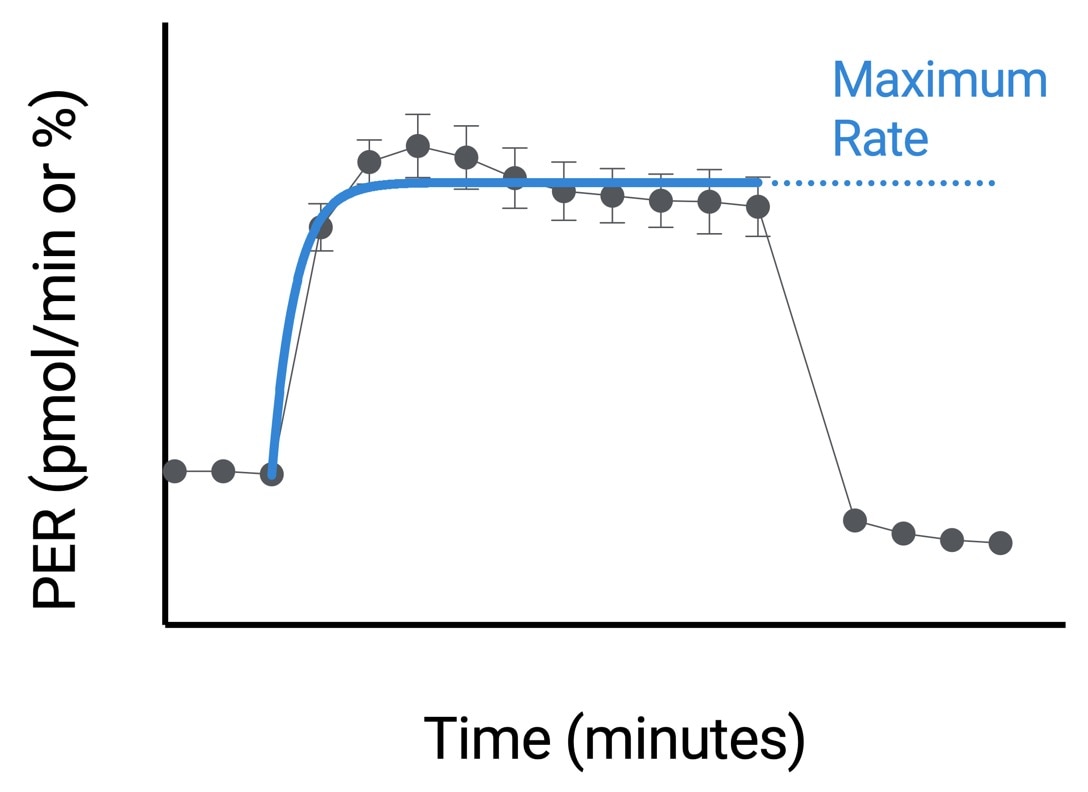 |
| 검량선 아래 면적 | 활성제 주입 후와 2-DG 주입 전의 속도 측정 데이터를 사용하여 Seahorse Analytics에서 계산됩니다. AUC 값에는 베이스라인 위의 피크 값만 포함됩니다. 이 계산 분석법에 대한 자세한 내용은 다음을 참조하세요. H. J. Motulsky, "How to: Area under the curve", GraphPad Statistics Guide. Accessed 20 May 2020. https://www.graphpad.com/guides/prism/8/statistics/stat_area_under_the_curve.htm 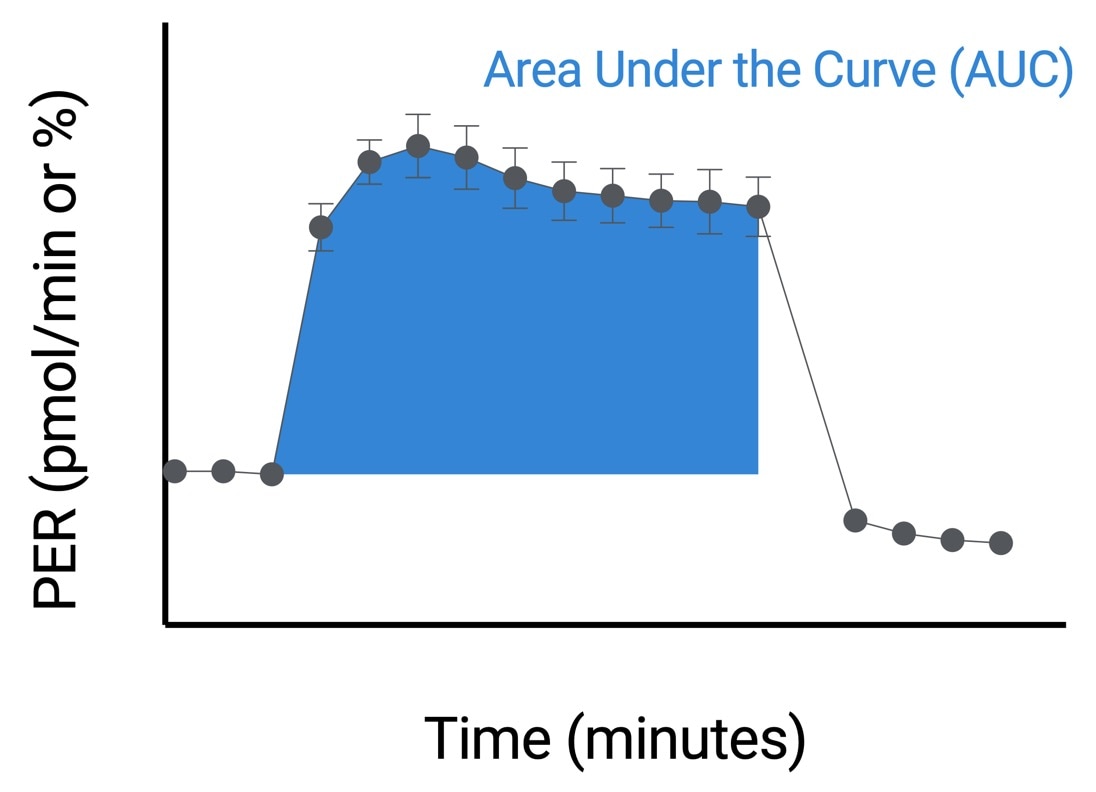 |
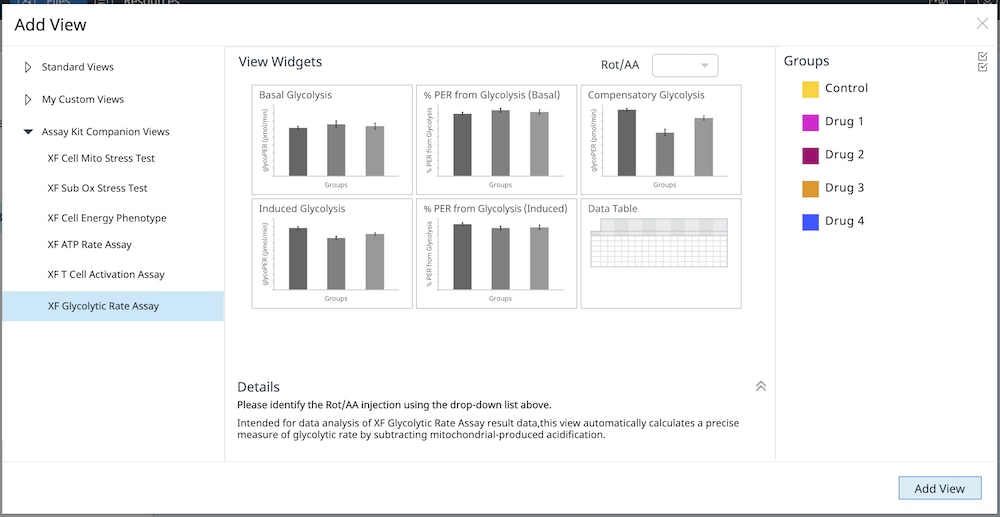
6.4. Assay Kit Companion Analysis View(어세이 키트 관련 분석 보기) » XF Glycolytic Rate Assay(XF 해당 속도 어세이): 단일 분석 보기에서 XF 해당 속도 어세이 파라미터를 계산하고 표시하려면 아래 단계를 따르세요. 이 분석 보기와 이 분석 보기의 위젯을 어세이 결과 파일에 추가하려면 buffer factor를 적합하게 구성해야 합니다.
- Add View(보기 추가) 창에서 Assay Kit Companion View(어세이 키트 관련 보기) 목록을 클릭하여 옵션 목록을 확장합니다.
- XF Glycolytic Rate Assay(XF 해당 속도 어세이) 보기를 클릭하여 어세이 파라미터 위젯을 표시합니다.
- 유도 XF 해당 속도 어세이(rontenone/antimycin A 및 2-DG의 표준 주입 전 1회 또는 2회 주입)의 경우, 위젯 위에 표시된 드롭다운 메뉴를 사용하여 Rotenone/Antimycin-A 주입을 식별해야 이 분석 보기를 추가할 수 있습니다. 이 Rotenone/Antimycin-A 주입 선택은 어세이 파라미터를 정확하게 계산하는 데 중요한 역할을 합니다. 정확하지 않은 Rotenone/Antimycin-A 주입을 선택하면 위젯 계산 및 그래프가 정확하지 않게 됩니다. 이 두 가지 워크플로에 대한 자세한 내용은 XF 해당 속도 어세이 사용자 설명서를 참조하세요.
- 분석 보기에 추가할 원하는 파라미터 위젯을 선택합니다. 위젯 주위의 파란색 윤곽선은 해당 위젯이 선택되었음을 나타냅니다. 위젯이 회색으로 표시되면 어세이 파일에 파라미터를 계산하는 데 필요한 최소 주입 횟수가 없기 때문에 위젯을 선택할 수 없다는 의미입니다.
- 필요한 경우 group list(그룹 목록)에서 그룹을 끄고/켜고 Add View(보기 추가)를 클릭합니다.
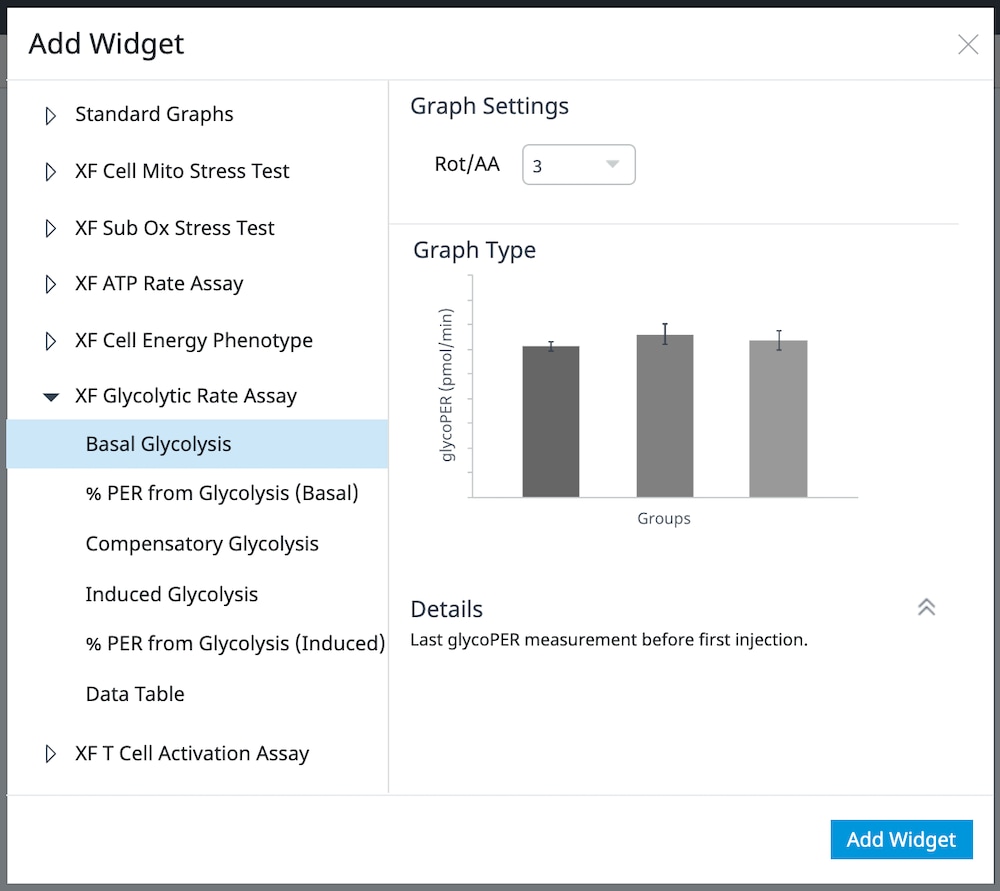
또한 기존 분석 보기에 개별 XF 해당 속도 어세이 파라미터 위젯(예: 기초 해당작용)을 추가할 수도 있습니다.
a. Add Widget(위젯 추가) 버튼(오른쪽에 빨간색 윤곽선으로 표시)을 클릭합니다.

b. XF 해당 속도 어세이 위젯 목록을 확장하고 원하는 위젯을 선택한 후 Add Widget(위젯 추가)을 클릭합니다.
중요: 유도 XF 해당 속도 어세이(rontenone/antimycin A 및 2-DG의 표준 주입 전 1회 또는 2회 주입)의 경우, 위젯 위에 표시된 드롭다운 메뉴를 사용하여 Rotenone/Antimycin-A 주입을 식별해야 이 분석 보기를 추가할 수 있습니다. 이 Rotenone/Antimycin-A 주입 선택은 어세이 파라미터를 정확하게 계산하는 데 중요한 역할을 합니다.정확하지 않은 Rotenone/Antimycin-A 주입을 택하면 위젯 계산 및 그래프가 정확하지 않게 됩니다.
아래 표는 표준 및 유도 어세이 워크플로 모두에 대한 XF 해당 속도 어세이 파라미터 계산을 설명합니다.
표준 XF 해당 속도 어세이
| 어세이 파라미터 | 수식 |
|---|---|
| 기초 해당작용 | 첫 주입 전 마지막 glycoPER 측정 |
| 기초 양성자 유출율(PER)* | 첫 주입 전 마지막 PER 측정 |
| 해당작용으로 인한 % PER(기초) | (기초 해당작용) / (기초 PER) x 100% |
| * 이 파라미터가 Seahorse Analytics에서 개별적으로 보고되지 않고 다른 보고된 파라미터 값을 계산하는 데 사용됨을 나타냅니다. | |
유도 XF 해당 속도 어세이
| 어세이 파라미터 | 수식 |
|---|---|
| 기초 해당작용 | 첫 주입 전 마지막 glycoPER 측정 |
| 기초 양성자 유출율(PER)* | 첫 주입 전 마지막 PER 측정 |
| 해당작용으로 인한 % PER(기초) | (기초 해당작용) / (기초 PER) x 100% |
| 보상적 해당작용 | Rot/AA 주입 후 최대 glycoPER 측정 |
| 유도 해당작용 | 유도 어세이 주입 후 및 Rot/AA 주입 전의 glycoPER 측정 평균 |
| 유도 PER* | 유도 어세이 주입 후와 다음 주입 전의 PER 측정 평균 |
| 해당작용으로 인한 % PER(유도) | (유도 해당작용) / (유도 PER) x 100% |
| * 이 파라미터가 Seahorse Analytics에서 개별적으로 보고되지 않고 다른 보고된 파라미터 값을 계산하는 데 사용됨을 나타냅니다. | |
그래프로 표시된 위젯 데이터 편집: 위젯에 대해 그래프로 표시된 데이터를 사용자 정의하려면 위젯을 두 번 클릭하여 위젯 편집기 보기를 엽니다. 특정 위젯에 대해 그래프로 표시된 데이터를 사용자 정의할 수 있는 다양한 방법이 있습니다. 각 위젯의 플레이트 맵은 독립적이라는 점을 기억하는 것이 중요합니다. 즉, 위젯 편집기 보기에서 변경한 사항은 해당 위젯에만 적용된다는 의미입니다.
각 그래프 위의 리본에 있는 기능은 속도 데이터 유형을 변경하거나, 정규화를 켜고 끄거나, 그룹 평균이 아닌 데이터를 웰별로 보는 등 해당 위젯 유형에 특정한 편집 기능을 제공합니다. 이러한 기능과 이를 사용하는 방법에 대한 자세한 내용은 다양한 위젯 설명을 참조하세요.

그래프 오른쪽에 있는 플레이트 맵을 사용하면 선택한 위젯 유형에 대한 계산 및 그래프 데이터에서 특정 어세이 웰을 포함하거나 제외할 수 있습니다.
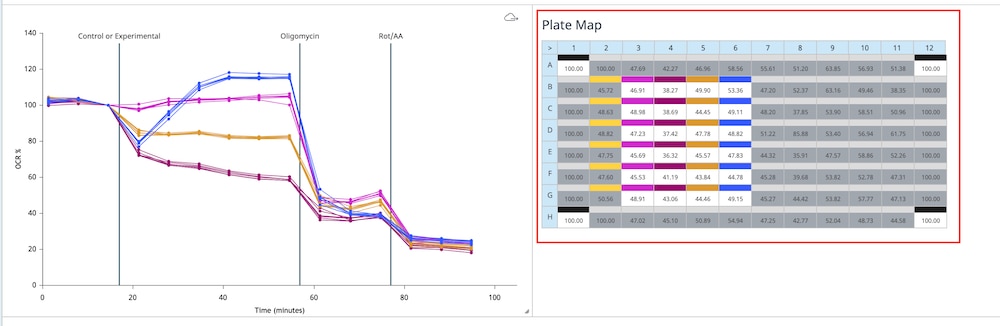
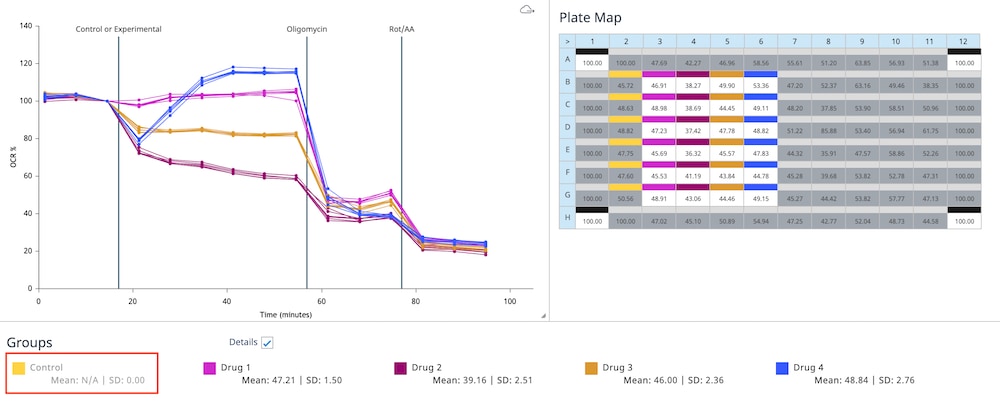
위젯 아래의 그룹 목록에는 선택한 위젯 유형에 대한 그룹 평균 및 오류 데이터가 표시됩니다. 그룹 이름을 두 번 클릭하면 위젯 그래프에서 해당 그룹의 모든 데이터를 표시하거나 숨길 수 있습니다. 플레이트 맵에서 꺼진 어세이 웰은 그룹 목록에 표시되는 값에 포함되지 않습니다. 그래프 데이터에서 특정 그룹이 제외되면 아래 이미지의 "Control" 그룹과 같이 해당 그룹이 회색으로 표시됩니다.
Buffer Factor 정의
일반적인 분석 워크플로는 어세이 결과 파일에서 어세이 배지와 백그라운드 웰에 대한 buffer factor를 정의하는 것입니다. 이 정보는 Seahorse Analytics(예: XF T 세포 활성화 실험)의 여러 어세이 키트 수반 분석 보기의 많은 위젯에서 계산되고 표시되는 양성자 유출율(PER)을 계산하는 데 필요합니다. buffer factor가 제대로 구성되지 않은 어세이 결과 파일에 분석 보기를 추가하려고 하면 오류 메시지가 표시됩니다(아래 그림). buffer factor가 어세이 결과 파일의 배지 및 백그라운드 웰에 적합하게 할당되면 원하는 위젯 및/또는 분석 보기를 열 수 있습니다.
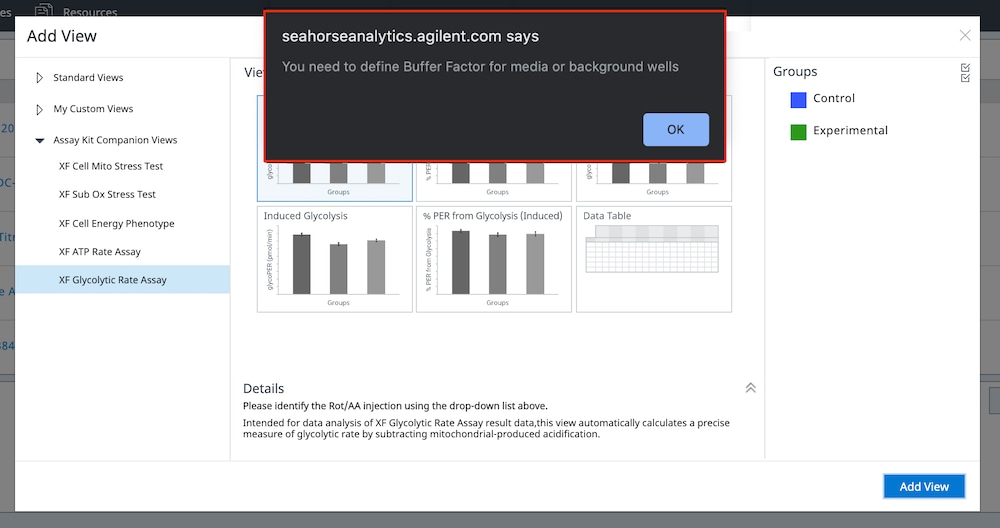
buffer factor 오류를 해결하는 단계 – 데이터 파일에 첫 번째 분석 보기를 추가할 때 위 그림과 같은 오류가 표시되면 아래 1단계부터 시작하세요. 데이터 파일에 이미 분석 보기가 열려 있는 경우 3단계부터 시작하세요.
- OK(확인)를 클릭하여 오류 대화 상자를 닫습니다.
- Add View(보기 추가) 창에서 Standard Views(표준 보기) > Quick View(빠른 보기)를 선택하고 OCR 키네틱 그래프 위젯을 선택합니다.
- 분석 보기에서 Modify(수정)(응용 상단에 있는 진한 파란색 리본의 오른쪽 상단 모서리)을 클릭합니다.
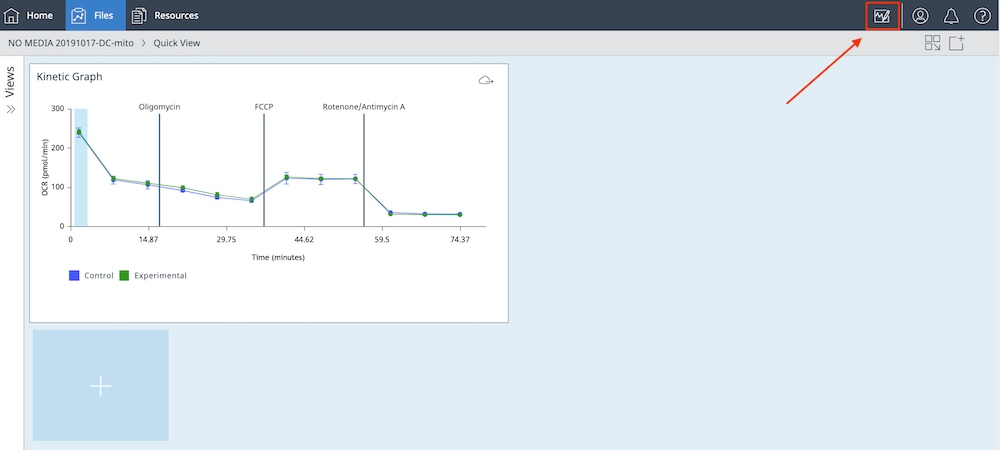
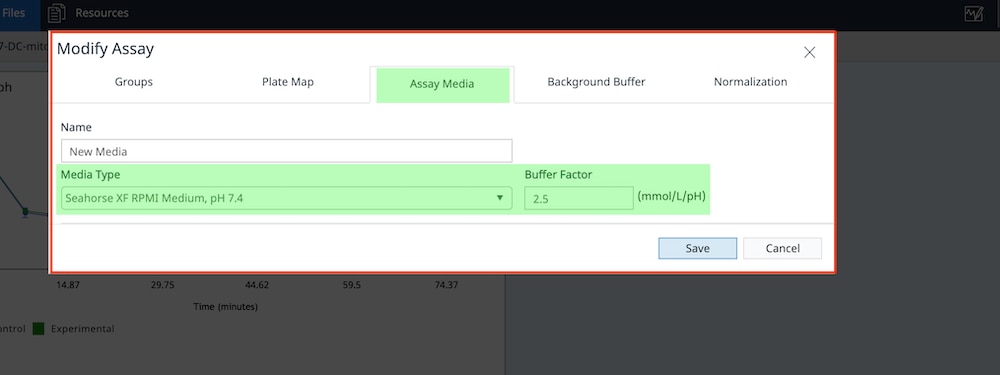
- Assay Media(어세이 배지) 탭을 클릭하여 buffer factor가 어세이 배지 그룹 정의에 할당되었는지 확인합니다. 여기에 buffer factor 값이 표시되지 않으면 Media Type(배지 유형) 드롭다운 메뉴를 사용하여 정확한 Agilent Seahorse XF 어세이 배지를 선택할 수 있습니다.
Seahorse XF RPMI 및 DMEM Medium, pH 7.4 옵션은 모두 배지에 buffer factor를 자동으로 할당합니다. 사용자 정의 어세이 배지를 사용하는 경우, 사용자 정의 배지의 buffer factor를 입력해야 합니다.
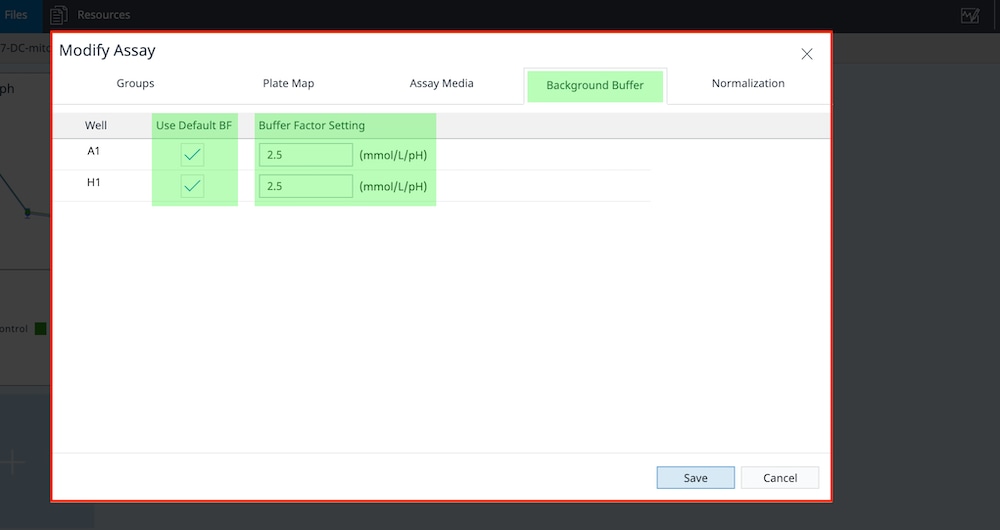
- Background Buffer 탭을 클릭하여 buffer factor가 백그라운드 웰에 할당되었는지 확인합니다. Seahorse XF RPMI 및 DMEM Medium 사용을 확인하기 위해 Use Default BF(기본 BF 사용) 확인란을 선택하면 pH 7.4와 buffer factor 값이 자동으로 가져와집니다. 사용자 정의 어세이 배지를 사용하는 경우, 사용자 정의 배지의 buffer factor를 입력해야 합니다.
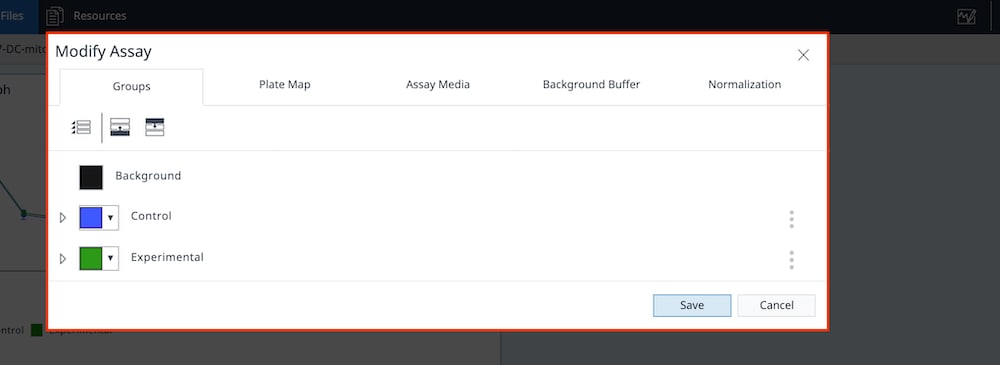
- Groups(그룹) 탭을 클릭하여 어세이 배지가 각 어세이 그룹에 할당되었는지 확인합니다.
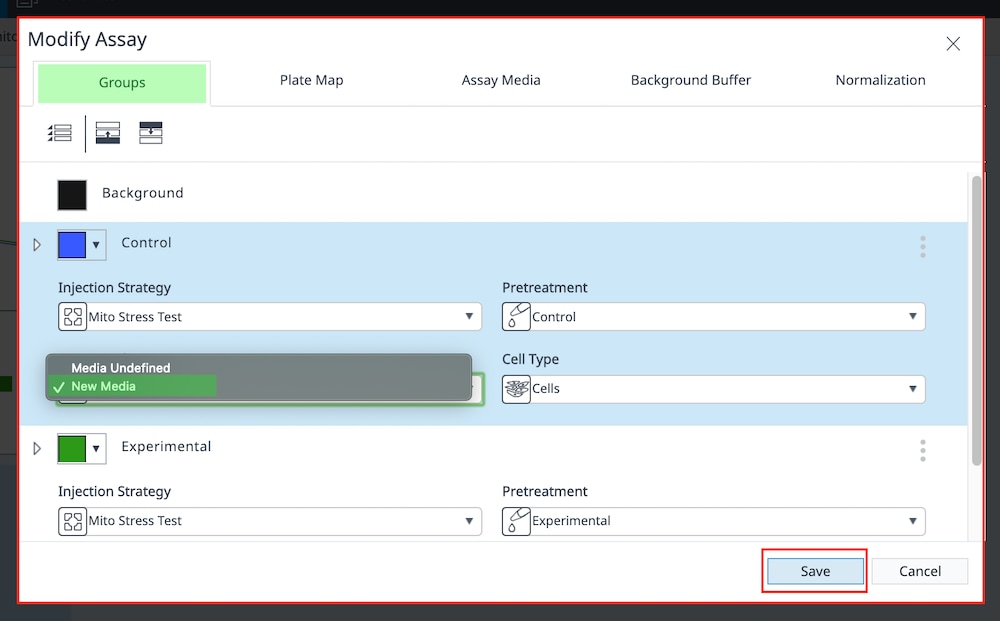
- 완료되면 Save(저장)를 클릭합니다. 위 단계를 수행(또는 수정)하고 나면 분석 보기(또는 위젯)를 데이터 파일에 추가할 수 있습니다. 이 단계를 수행한 후에도 “배지 또는 배경 그룹에 대한 buffer factor를 정의해야 합니다”라는 메시지가 계속 표시되면 다음 주소로 애질런트 세포 분석 지원 팀에 문의하세요. cellanalysis.support@agilent.com
5.3 데이터 유형
세포의 산소 소비(호흡)와 양성자 배출(해당작용)은 세포 외 산소와 양성자의 농도에 변화를 일으키는데, 이를 빠르고 쉽게 측정할 수 있습니다. Agilent Seahorse XF 분석기는 세포 외 산소와 양성자 농도의 변화를 실시간으로 측정합니다. Seahorse Analytics를 사용하면 다음 유형의 데이터에 쉽게 액세스하고 검토할 수 있습니다.
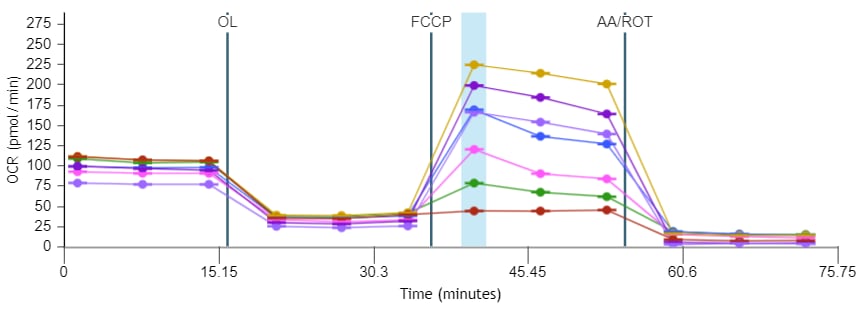
1. 속도 데이터는 모든 Seahorse XF 분석기의 기본 출력입니다. Seahorse Analytics에서 계산 및 보고되는 3가지 유형의 속도 데이터는 다음과 같습니다.
산소 소비율(OCR): 웰 내 시료의 산소 소비량을 정량적으로 측정하여 시간 경과에 따른 세포 및 미토콘드리아 호흡을 측정합니다. 피코몰/분(pmol/분) 대 시간 단위로 보고됩니다. 산소 소비율(OCR) 데이터는 다음과 같이 표시됩니다. 산소 소비율(OCR) 데이터는 속도 모드(오른쪽 그림)에 표시됩니다. 위젯 추가 기능을 사용하여 분석 보기에 키네틱 그래프를 추가하면 기본적으로 표시되는 속도는 OCR입니다.
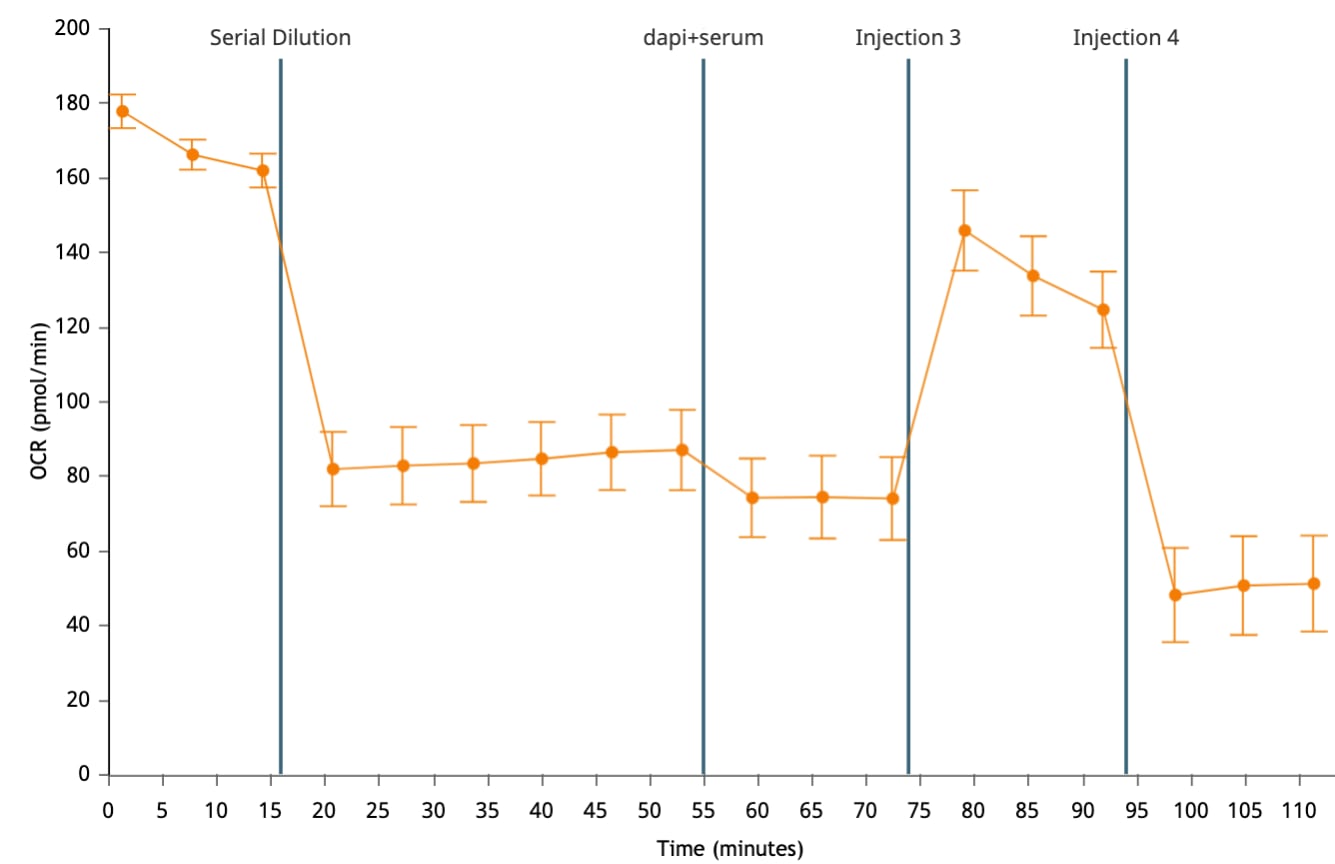
중요! 코팅되지 않은 세포 플레이트의 경우 (XFe96, XFe24, XFp, XF HS Mini)에 권장되는 일반 OCR 데이터 범위는 다음과 같습니다.
- 백그라운드 웰: 37°C에서 0 ± 20(pmol/분)
- 어세이 웰: 베이스라인 측정의 경우 37°C에서 20-160 / 50-400(pmol/분).
이러한 값은 일반적인 권장 사항이며 분석된 어세이 및/또는 세포 유형에 따라 다를 수 있습니다.
세포 외 산성화율(ECAR): 시간 경과에 따른 세포 외 배지 내 양성자 배출을 정성적으로 측정한 것으로, milli-pH/분(mpH/분) 대 시간으로 보고됩니다. 세포 외 산성화율(ECAR) 데이터는 속도 모드에 표시됩니다(오른쪽 그림). 키네틱 그래프 위의 Rate(속도) 드롭다운 메뉴 컨트롤을 사용하여 키네틱 그래프 위젯 편집기 보기에 ECAR 데이터를 표시할 수 있습니다.
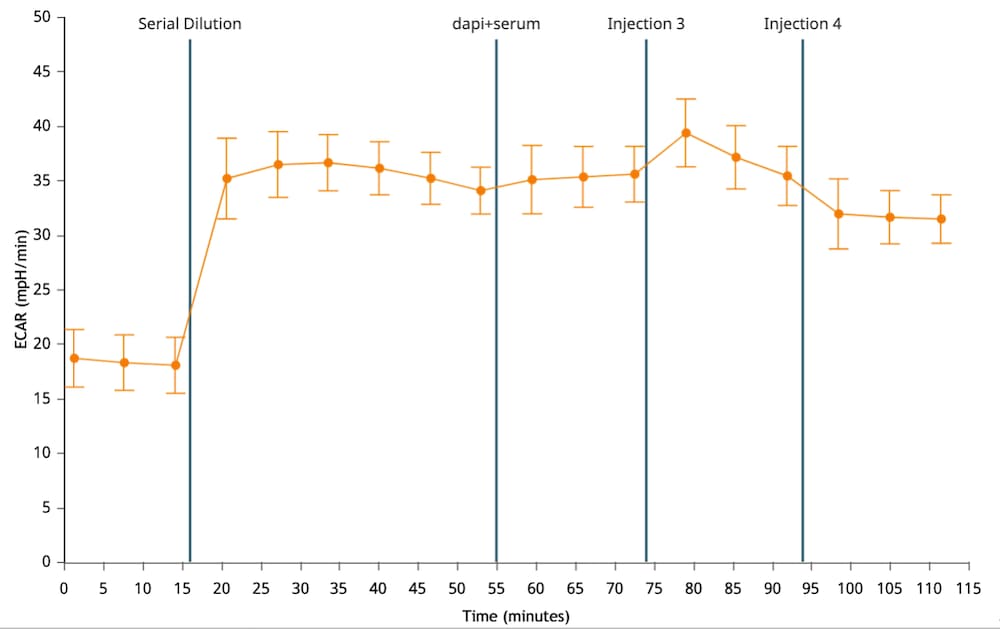
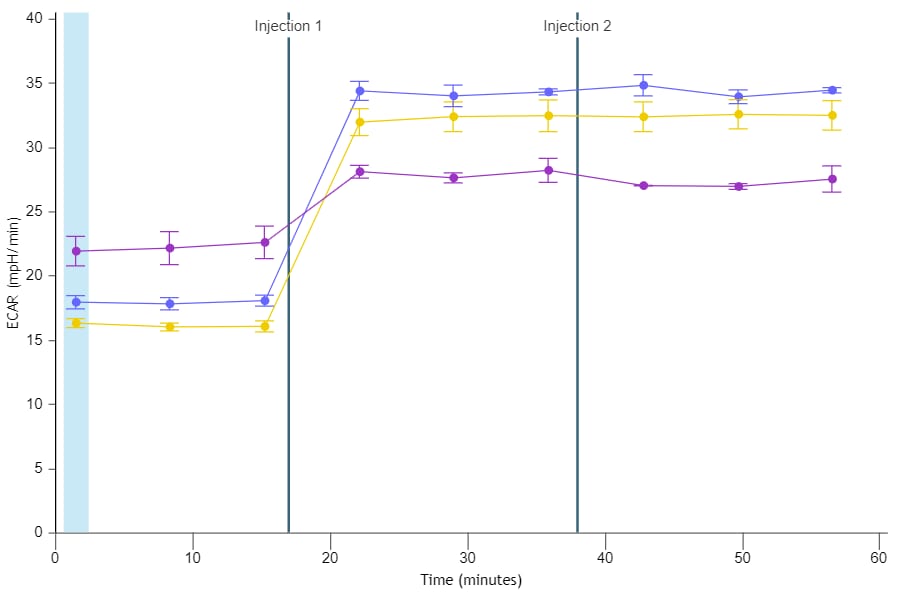
중요! 코팅되지 않은 셀 플레이트의 경우 (XFe96, XFe24, XFp, XF HS Mini)에 대한 ECAR 데이터의 일반 범위는 다음과 같습니다.
- 백그라운드 웰: 37°C에서 0 ± 10(mpH/분)
- 어세이 웰: 베이스라인 측정의 경우 37°C에서 10-90 / 20-120(mpH/분).
이러한 값은 일반적인 권장 사항이며 분석된 어세이 및/또는 세포 유형에 따라 다를 수 있습니다.
양성자 유출율(PER): 배지 완충 능력과 플레이트 구조를 설명하는 세포 외 산성화의 정량적 측정치입니다. 피코몰/분(pmol/분) 대 시간으로 보고됩니다. 실행 후 어세이 결과 분석에서만 사용할 수 있습니다. PER은 어세이 실행 동안 계산되지 않습니다. 키네틱 그래프 위의 Rate(속도) 드롭다운 메뉴 컨트롤을 사용하여 키네틱 그래프 위젯 편집기 보기에 PER 데이터를 표시할 수 있습니다.
2. 레벨 데이터는 속도 데이터를 계산하는 데 사용되며 일반적으로 XF 분석 워크플로의 첫 번째 단계인 데이터 품질 평가에 사용됩니다.
산소 농도(O2 분압, mmHg): 세포(또는 기타 생물학적 물질)가 속도 측정 주기 동안 산소를 소비하므로 어세이 배지의 산소 농도가 감소합니다. 산소 농도의 이러한 감소는 산소 소비율(OCR, pmol/분)을 계산하는 데 사용됩니다. 키네틱 그래프 위에 있는 Y1 레벨을 전환하여 키네틱 그래프 위젯 편집기 보기에 산소 분압 레벨 데이터를 표시할 수 있습니다. 산소 분압(O2) 데이터는 mmHg 대 시간으로 표시됩니다(오른쪽 그림).
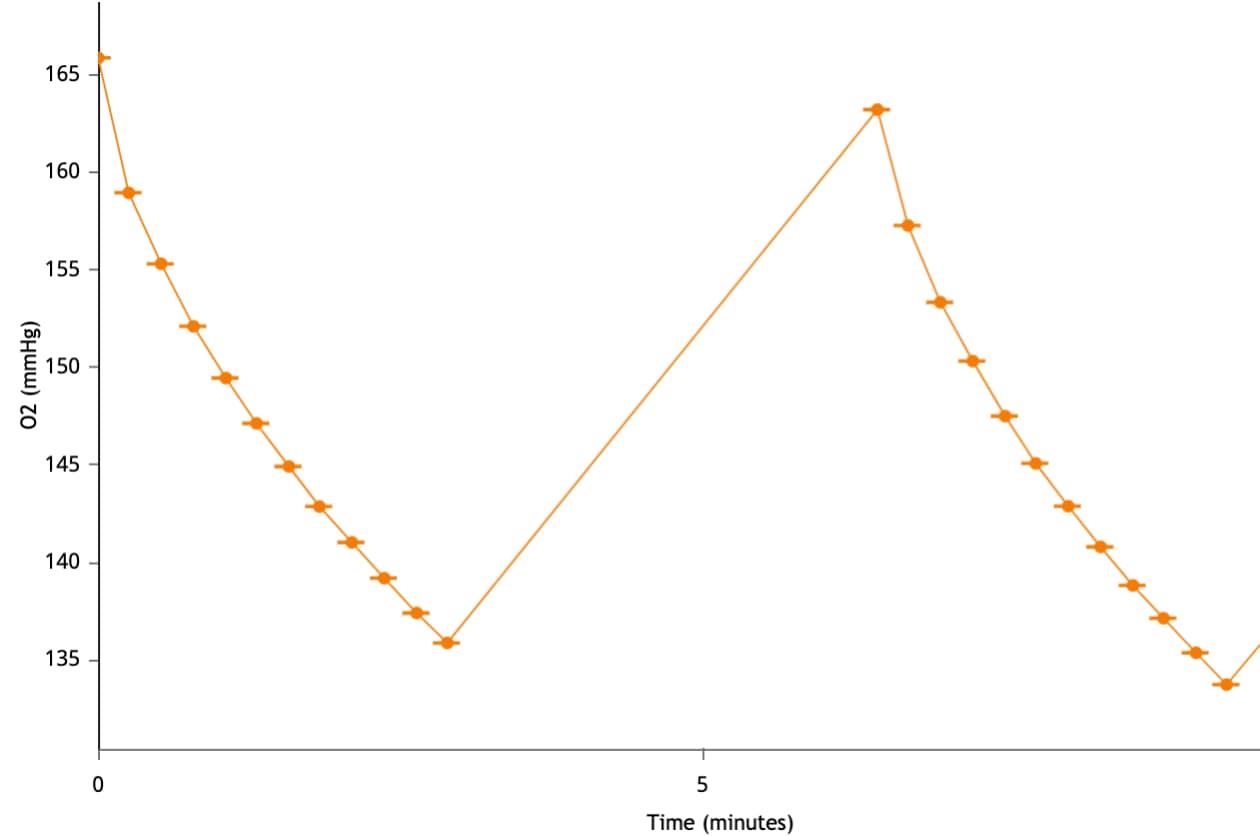
중요! 각 어세이 결과 파일의 산소 분압(O2) 레벨 데이터를 검토하는 것이 좋습니다. 코팅되지 않은 셀 플레이트를 사용하는 경우, 초기 권장 산소 분압(O2) 레벨 데이터는 다음과 같습니다.
- 백그라운드 웰: 37°C에서 152 ± 10(mmHg)
- 어세이 웰: 37°C에서 152 ± 10(mmHg)
- 측정 주기가 끝날 때 산소 분압은 2040mmHg 아래로 내려가서는 안 됩니다.
- 다음 측정 주기 시작 시의 산소 분압은 이전 측정의 초기 산소 분압과 동일해야 합니다.
이러한 값은 일반적인 권장 사항이며 분석된 어세이 및/또는 세포 유형에 따라 다를 수 있습니다.
양성자 농도(pH): 속도 측정 주기 동안 세포(또는 기타 생물학적 물질)가 양성자를 배출함에 따라 어세이 배지의 양성자 농도가 증가합니다. 마이크로챔버의 양성자 농도는 XF 어세이를 통해 측정되고 세포 외 산성화 속도(ECAR, mpH/분)로 계산됩니다. 먼저 Rate(속도) 드롭다운 메뉴를 사용하여 ECAR을 선택한 다음 Y1에 대한 레벨을 전환하여 키네틱 그래프 위젯 편집기 보기에 양성자 농도 레벨 데이터를 표시할 수 있습니다. 이 때 키네틱 그래프 위의 컨트롤을 사용합니다. 양성자 농도(pH) 데이터는 pH 대 시간으로 표시됩니다(오른쪽 그림).
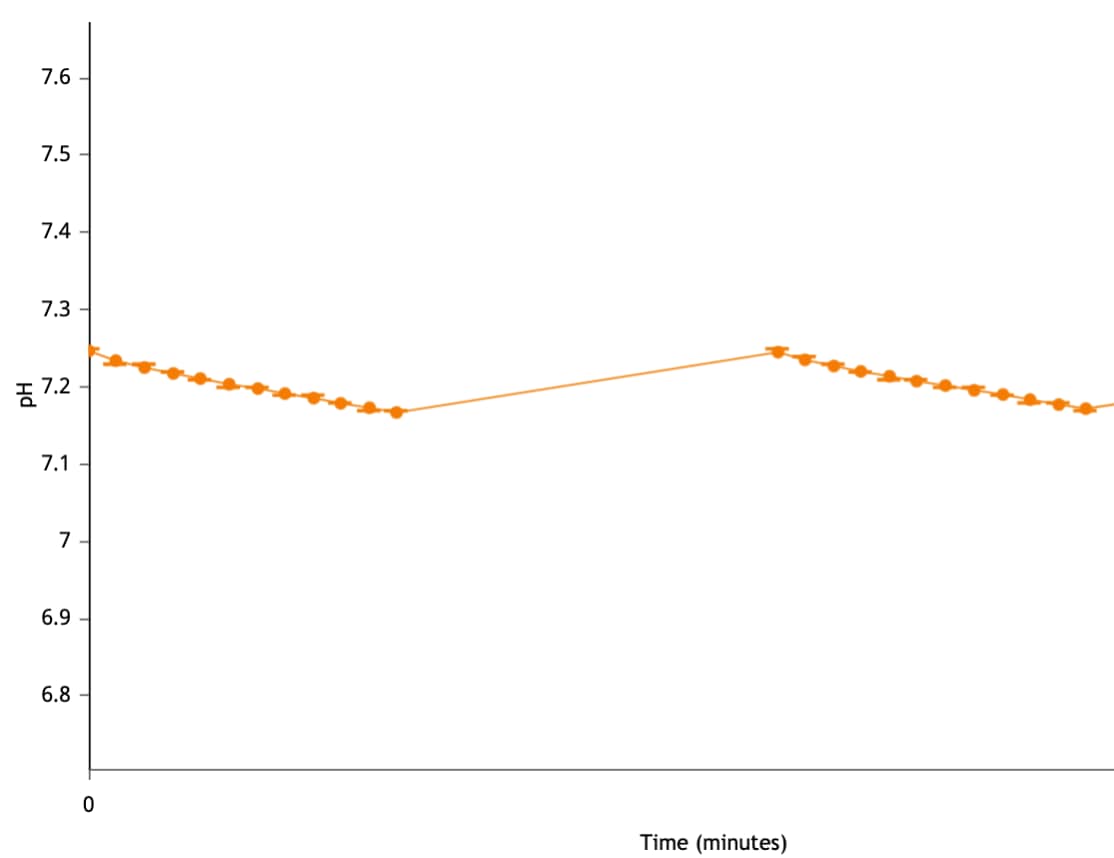
중요! 각 어세이 결과 파일에 대한 양성자 농도(pH) 레벨 데이터를 검토하는 것이 좋습니다. 코팅되지 않은 세포 플레이트와 Agilent Seahorse XF DMEM 또는 XF RPMI 배지, pH 7.4를 사용할 때 초기 권장 양성자 농도(pH) 레벨 데이터 범위는 다음과 같습니다.
- 백그라운드 웰: 37°C에서 7.4 ± 0.1[pH]
- 어세이 웰: 37°C에서 7.4 ± 0.1[pH]
- 측정 주기가 끝날 때 pH 값은 pH 6.4 아래로 내려가서는 안 됩니다.
- 다음 측정 주기 시작 시의 pH 값은 이전 측정의 시작 pH 값과 동일해야 합니다.
이러한 값은 일반적인 권장 사항이며 분석된 어세이 및/또는 세포 유형에 따라 다를 수 있습니다.
관련 지원 자료
참고 자료
5.4 데이터 표시 옵션
Agilent Seahorse Analytics는 선호하는 분석 보기 유형에 따라 어세이 결과 데이터를 분석하고 해석할 수 있는 다양한 그래프 유형을 제공합니다. 분석 보기 생성 및 사용자 정의에 대한 자세한 내용은 분석 보기 섹션을 참조하세요.
1. 위젯 유형 – 키네틱 그래프: 키네틱 그래프는 XF 결과 데이터를 표시하는 가장 일반적인 방법입니다. 여기서 x축은 시간(분)이고 y축은 측정된 분석물질의 농도 변화율입니다(O2 또는 H+). 키네틱 그래프 위젯의 y축에 표시할 수 있는 두 가지 유형의 데이터는 다음과 같습니다. (1) 속도 데이터 – 산소 소비율(OCR), 세포 외 산성화율(ECAR), 양성자 유출율(PER) 및 (2) 레벨 데이터 – 산소 분압(mmHg) 또는 양성자 농도[mpH].
- Add Widget(위젯 추가) > Standard Graphs(표준 그래프) » Kinetic Graph(키네틱 그래프):
Standard Graphs(표준 그래프) » Kinetic Graph(키네틱 그래프)을 사용하여 선택한 속도 유형(OCR, ECAR, PER) 및 측정의 막대 차트를 생성합니다.
Add Widget(위젯 추가) 버튼(오른쪽의 빨간색 윤곽선)을 클릭하고 Kinetic Graph(키네틱 그래프)(표준 그래프 목록에 있음)를 선택하여 Seahorse Analytics의 분석 보기에 키네틱 그래프 위젯을 추가할 수 있습니다.


참고: XF Real-Time ATP 생성률 어세이 결과 데이터(mitoATP 생성률, glycoATP 생성률 및 총 ATP 생성률) 분석을 위해 사용자 정의 보기에 추가할 수 있는 몇 가지 특수 키네틱 그래프도 있습니다. Add Widget(위젯 추가)을 클릭하고 XF ATP 생성률 어세이에 대한 위젯 옵션 목록을 확장하여 이러한 위젯을 찾을 수 있습니다(오른쪽 그림). 이러한 키네틱 그래프에서 계산된 데이터에 대한 자세한 내용은 이 백서를 살펴보세요.
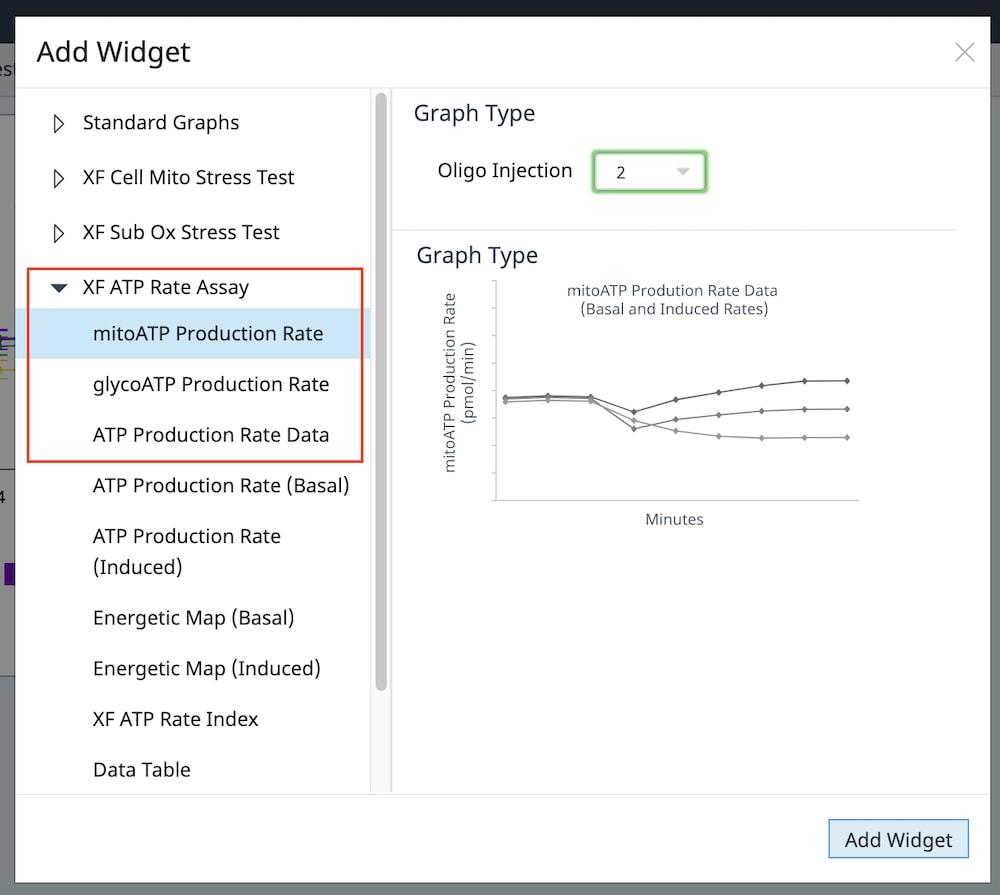
2. 위젯 유형 – 막대 차트: 막대 차트는 XF 데이터를 표시하는 또 다른 일반적인 방법으로, 최적의 FCCP 농도 및 세포 분주 밀도 결정과 같은 일상적인 XF 어세이에 도움을 줍니다. Seahorse Analytics는 분석 보기에 추가할 수 있는 다양한 막대 차트 옵션을 제공하며 대부분은 어세이 전용입니다. 특정 막대 차트 위젯에 대한 자세한 내용은 여기 또는 Seahorse Analytics에서 특정 어세이 키트 관련 분석 보기를 참조하세요.
- Add Widget(위젯 추가) > Standard Graphs(표준 그래프) » Bar Chart(막대 차트):
Standard Graphs(표준 그래프) » Bar Chart widget(막대 차트 위젯)을 사용하여 선택한 속도 유형(OCR, ECAR, PER) 및 측정의 막대 차트를 생성합니다.
예를 들어, 모든 그룹에 대해 속도 측정 10의 OCR 데이터를 표시하려면 다음과 같이 합니다.
- Add Widget(위젯 추가) 버튼 클릭
- Standard Graphs(표준 그래프) 목록 확장
- Bar Chart(막대 차트) 선택
- Add Widget(위젯 추가) 클릭
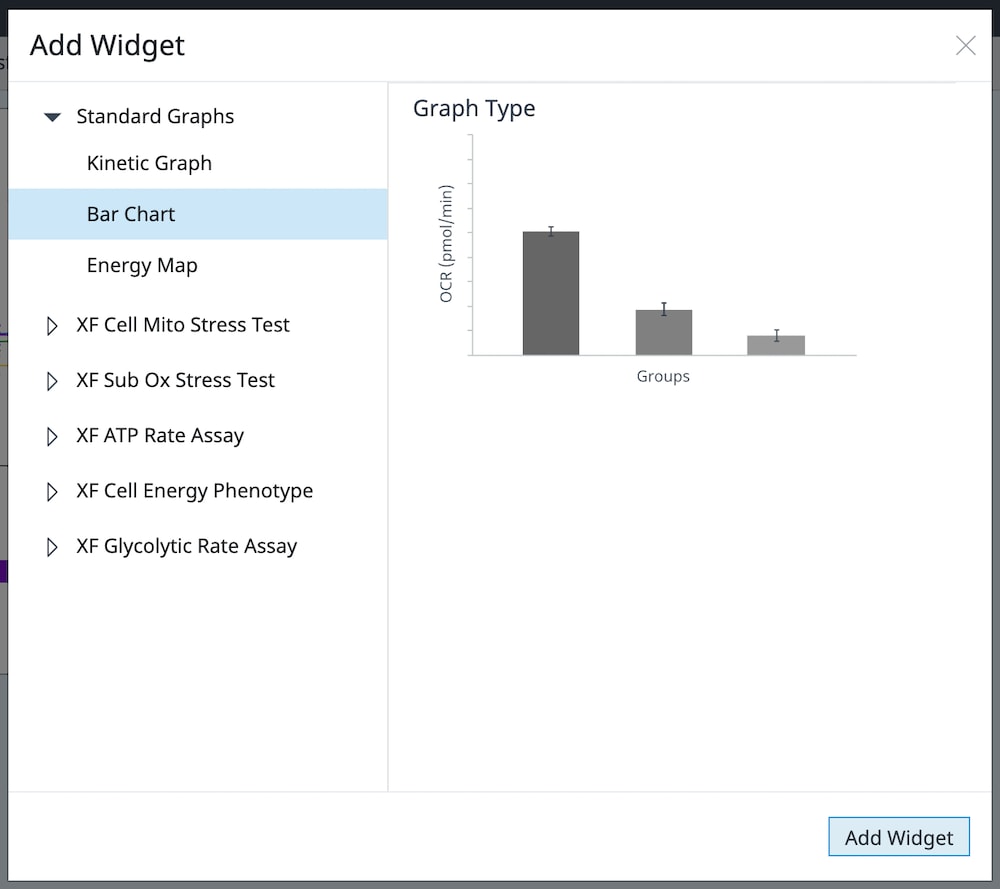
위젯 편집기 보기에서 Rate(속도) 드롭다운 메뉴를 사용하여 속도 측정 10을 선택한 다음 뒤로 화살표(위젯 편집기 보기의 왼쪽 상단 모서리)를 클릭하여 분석 보기로 돌아갑니다.

3. 위젯 유형 – 에너지 맵: 에너지 맵 위젯은 X 및 Y 산포도로, 전체 또는 선택한 그룹의 선택한 속도 측정에 대해 두 가지 유형의 속도 데이터를 비교할 수 있습니다. 아래에 설명된 에너지 맵 위젯 외에도 어세이 유형에 따라 분석 보기 섹션에 정의된 분석 보기에 추가할 수 있는 몇 가지 추가 산포도 위젯 옵션이 있습니다.
- Add Widget(위젯 추가) > Standard Graphs(표준 그래프)» Energy Map(에너지 맵):
Standard Graphs(표준 그래프) » Energy Map(에너지 맵) 위젯을 사용하여 y축에 산소 소비율 데이터(OCR)의 산포도를 생성하고, 산성화 속도 데이터(ECAR 또는 PER)는 x축에 위치하여 각각의 선택한 속도 측정 그룹에 대한 상대적 경로 활용도를 나타냅니다.
Measurement(측정) 드롭다운 메뉴를 사용하여 어세이의 다른 속도 측정에 대한 그룹 데이터를 표시합니다.
Rate(속도) 드롭다운 메뉴를 사용하여 x축의 산성화 속도를 PER(또는 ECAR)로 변경합니다. OCR은 항상 y축에 표시됩니다.
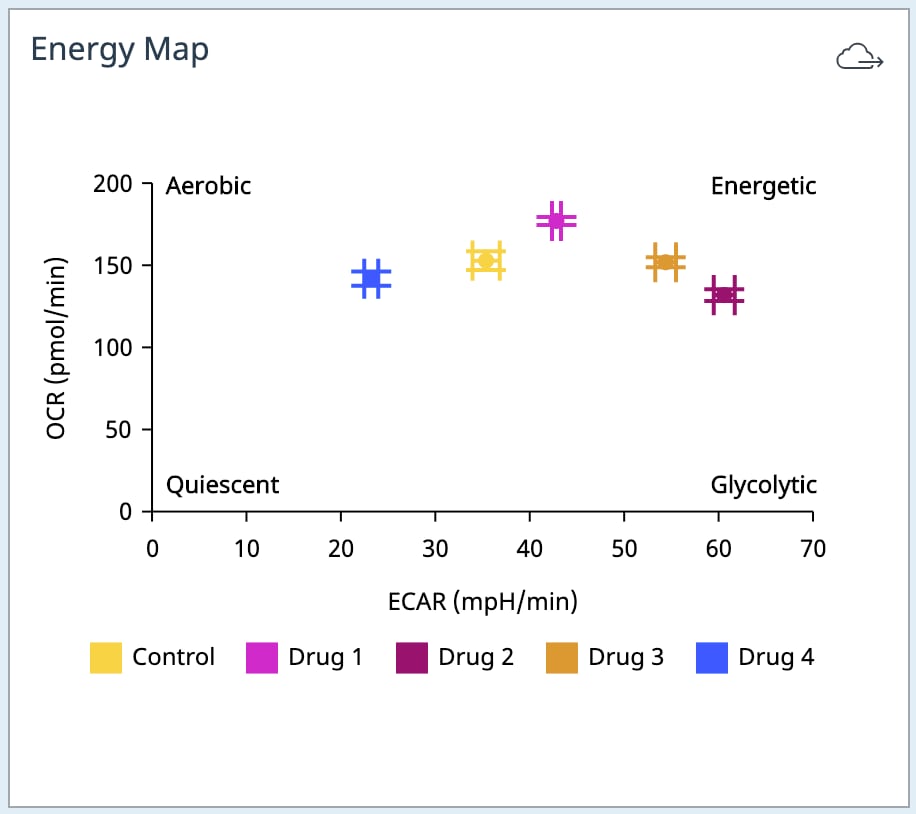
- Add Widget(위젯 추가) > XF ATP Rate Assay(XF ATP 생성률 어세이) » Energetic Map (Basal) widget(에너지 맵(기초) 위젯):
에너지 맵(기초) 데이터 위젯은 XF ATP 생성률 어세이 위젯 목록에 있으며 Agilent Seahorse XF Real-Time ATP 생성률 어세이에 대한 표준 및 유도 워크플로 분석에 적용할 수 있습니다. 이 두 가지 워크플로에 대한 자세한 내용은 XF Real-Time ATP 생성률 어세이 사용자 설명서를 참조하세요. 또한 이 위젯 데이터를 계산하려면 buffer factor를 어세이 배지, 백그라운드 웰 및 어세이 그룹에 적합하게 할당해야 합니다.
에너지 맵(기초) 위젯은 y축에 기초 mitoATP 생성률을 표시하고 x축에 기초 glycoATP 생성률을 표시합니다(아래 그림, 왼쪽). 이 위젯에 사용된 계산은 Add Widget(위젯 추가) 대화 상자(오른쪽 그림)의 세부 정보에서 확인할 수 있습니다.
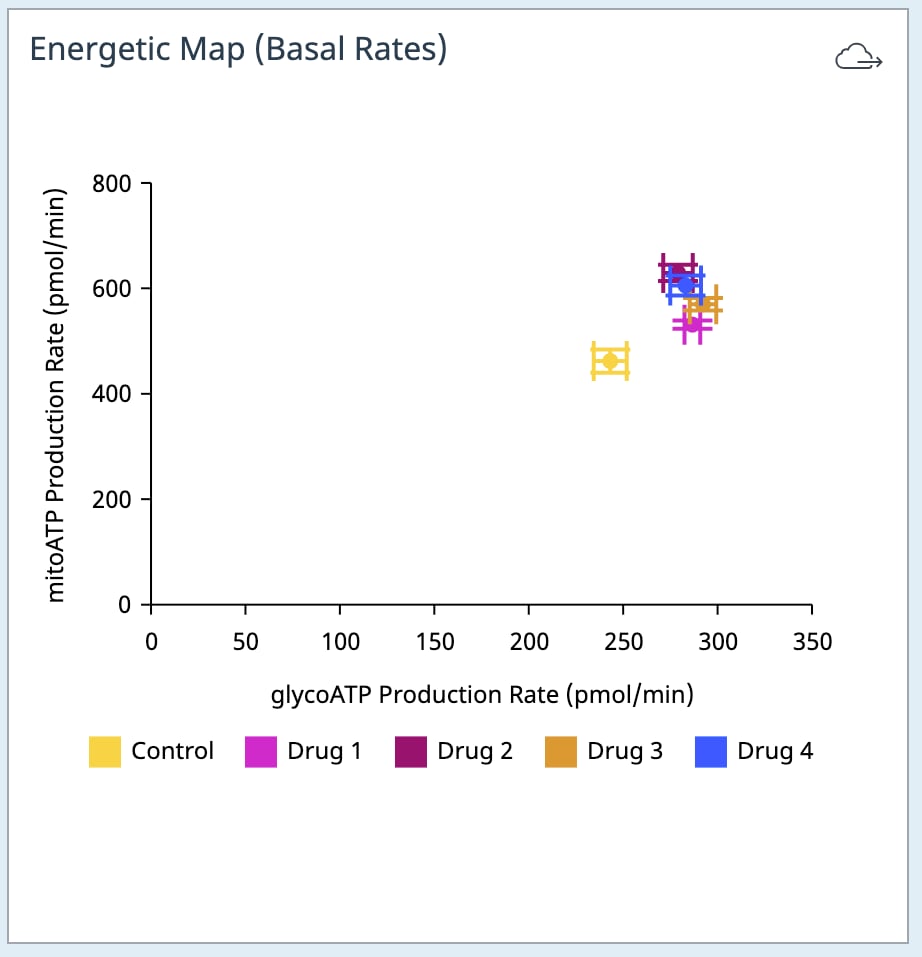
2회 이상의 주입이 포함된 XF ATP 생성률 어세이의 경우 이 위젯을 분석 보기에 추가하려면 먼저 위젯 추가(오른쪽 그림)에 표시된 드롭다운 메뉴를 사용하여 oligomycin 주입을 식별해야 합니다. 이 oligomycin 주입 선택은 위젯에 표시되는 올바른 기초 ATP 생성률을 계산하는 데 중요한 역할을 하기 때문입니다. 정확하지 않은 Oligomycin 주입을 선택하면 정확하지 않은 계산과 데이터가 발생합니다.
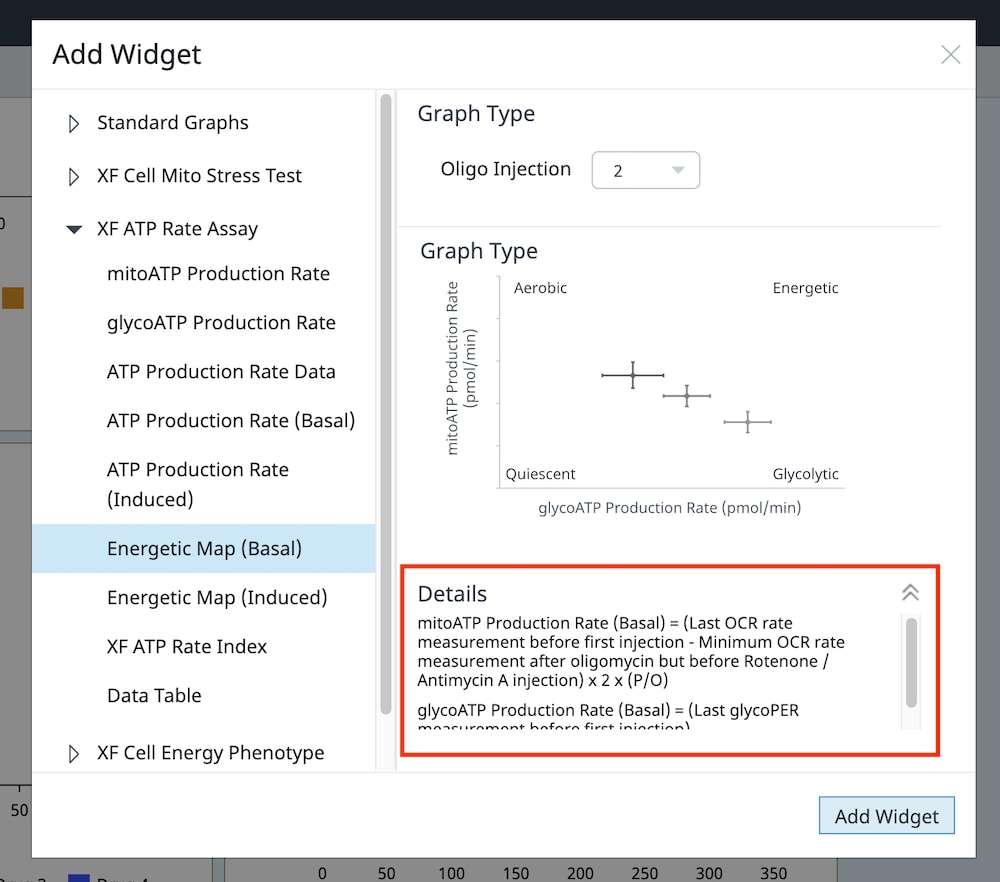
- Add Widget(위젯 추가) > XF ATP Rate Assay(XF ATP 생성률 어세이) » Energetic Map (Induced) widget(에너지 맵(유도) 위젯):
에너지 맵(유도) 데이터 위젯은 XF ATP 생성률 어세이 위젯 목록에도 있지만 Agilent Seahorse XF Real-Time ATP 생성률 어세이에 대한 유도 분석 워크플로에만 적용할 수 있습니다. 유도 어세이 워크플로에 대한 자세한 내용은 XF Real-Time ATP 생성률 어세이 사용자 설명서를 참조하세요. 또한 이 위젯 데이터를 계산하려면 먼저 buffer factor를 어세이 배지, 백그라운드 웰 및 어세이 그룹에 적합하게 할당해야 합니다.
에너지 맵(유도) 위젯은 y축에 유도 mitoATP 생성률을 표시하고 x축에 유도 glycoATP 생성률을 표시합니다(오른쪽 그림). 이 위젯에 사용된 계산은 Add Widget(위젯 추가) 대화 상자(아래 오른쪽 그림)의 세부 정보에서 확인할 수 있습니다.
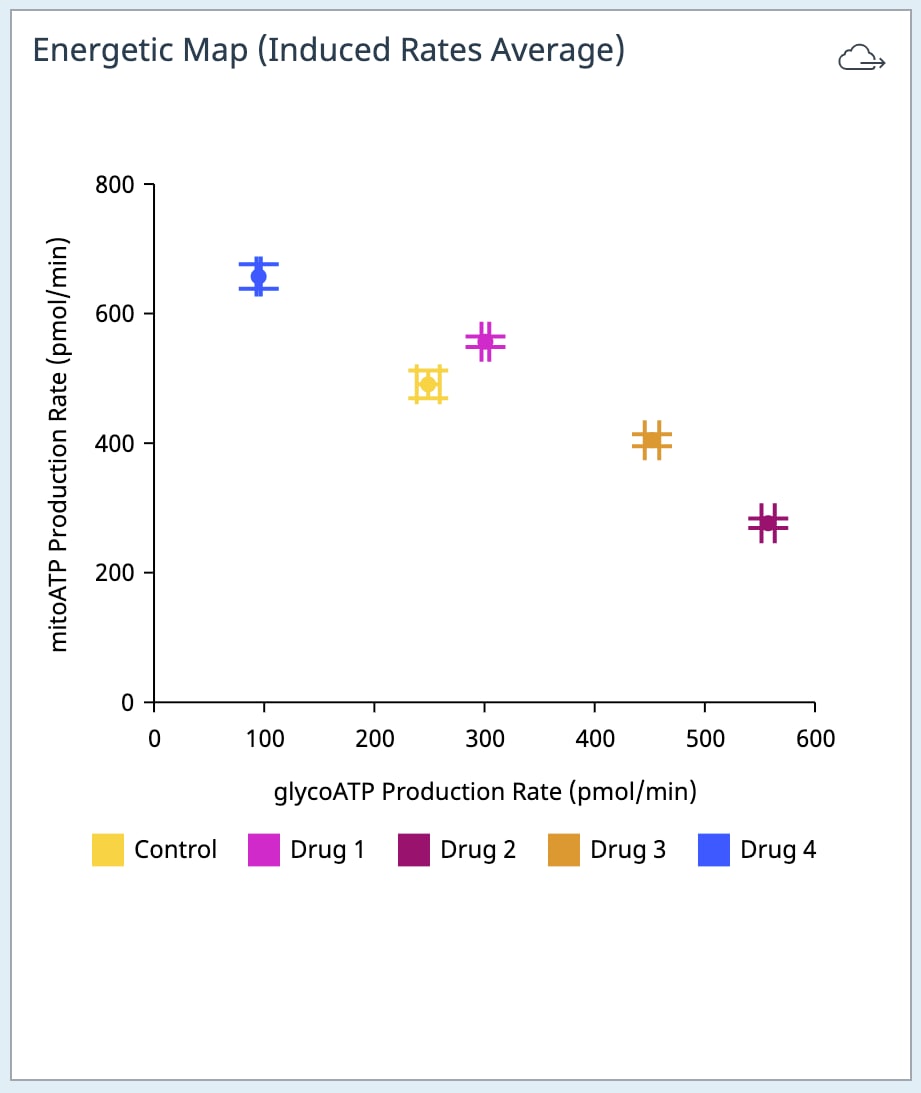
3회 이상의 주입이 포함된 XF ATP 생성률 어세이의 경우 이 위젯을 분석 보기에 추가하려면 먼저 위젯 추가(오른쪽 그림)에 표시된 드롭다운 메뉴를 사용하여 oligomycin 주입을 식별해야 합니다. 그 이유는 Oligomycin 주입 선택은 위젯에 표시되는 올바른 유도 ATP 생성률을 계산하는 데 중요한 역할을 하기 때문입니다. 정확하지 않은 Oligomycin 주입을 선택하면 정확하지 않은 계산과 데이터가 발생합니다.
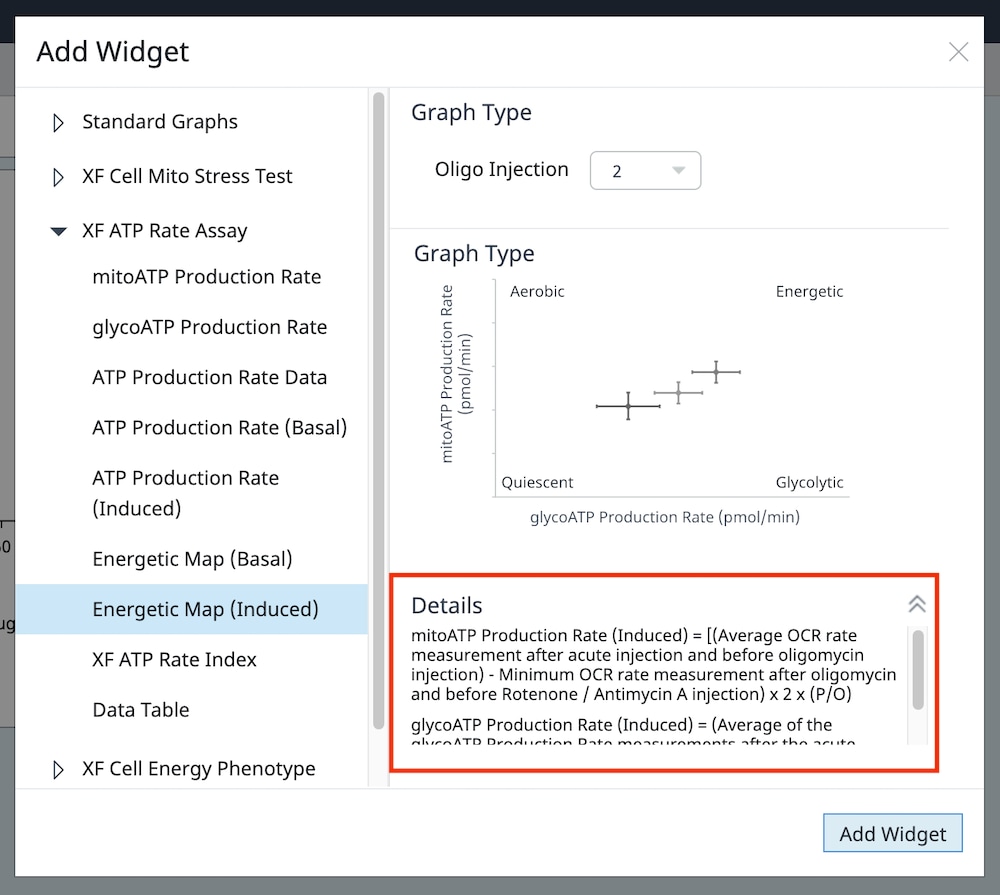
- Add Widget(위젯 추가) > XF Cell Energy Phenotype Test(XF 세포 에너지 표현형 테스트) » XF Cell Energy Phenotype widget(XF 세포 에너지 표현형 위젯): XF 세포 에너지 표현형 데이터 위젯은 XF 세포 에너지 표현형 위젯 목록에 있으며 XF 세포 에너지 표현형 테스트 데이터 분석에 사용됩니다.
- 이는 Seahorse Analytics의 다른 산포도 위젯 옵션과 비교할 때 독특한 위젯인데, 그룹당 2개의 데이터 포인트(베이스라인 표현형과 스트레스 표현형이 대사 잠재력이라는 점선으로 연결됨)를 표시하기 때문입니다. y축은 항상 OCR이고 x축은 항상 ECAR입니다(아래 그림 참조).
- 이 위젯에서 수행되는 계산에 대한 자세한 내용은 위젯 추가 세부 정보 표시 또는 XF 세포 에너지 표현형 테스트 키트 사용자 설명서를 참조하세요.
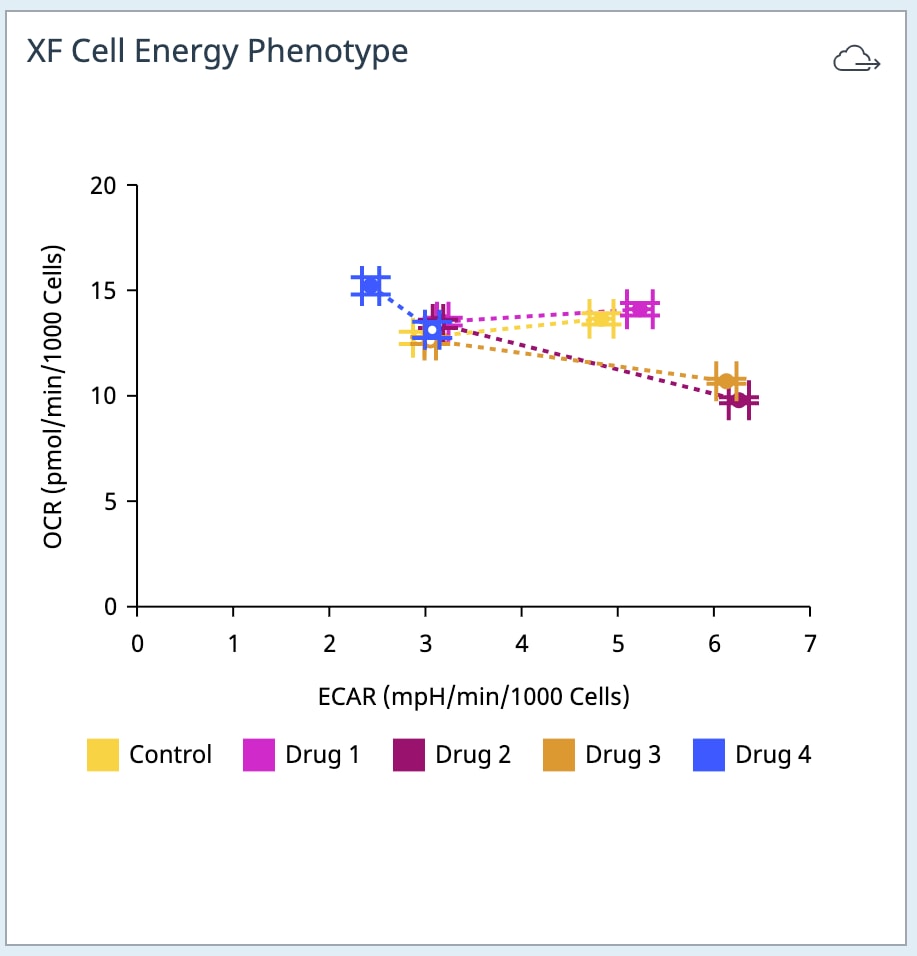
- 위젯 유형 – 기타: 키네틱 그래프, 막대 차트 및 산포도 위젯 외에도 Seahorse Analytics는 표준 및/또는 유도 XF Real-Time ATP 생성률 어세이 워크플로에 고유한 두 개의 추가 위젯을 제공합니다. 이 두 가지 워크플로에 대한 자세한 내용은 XF Real-Time ATP 생성률 어세이 사용자 설명서를 참조하세요. 또한 이 위젯 데이터를 계산하려면 먼저 buffer factor를 어세이 배지, 백그라운드 웰 및 어세이 그룹에 적합하게 할당해야 합니다.
2회 이상의 주입이 포함된 XF ATP 생성률 어세이의 경우 이 위젯을 분석 보기에 추가하려면 먼저 위젯 추가 대화 상자에 표시된 드롭다운 메뉴를 사용하여 oligomycin 주입을 식별해야 합니다. 그 이유는 이 oligomycin 주입 선택은 위젯에 보고되는 올바른 ATP 생성률을 계산하는 데 중요한 역할을 하기 때문입니다. 정확하지 않은 Oligomycin 주입을 잘못 선택하면 정확하지 않은 계산과 데이터가 발생합니다.- Add Widget(위젯 추가) > XF ATP Rate Assay(XF ATP 생성률 어세이) » Stacked bar chart(누적 막대 차트): 누적 막대 차트 위젯은 현재, XF ATP 생성률 어세이 위젯 목록에 있습니다. ATP 생성률(기초) 위젯은 각 그룹에 대한 기초 glycoATP 생성률(상단 파란색 막대)과 기초 mitoATP 생성률(하단 빨간색 막대)의 누적 막대 차트를 생성합니다(아래 그림, 왼쪽). 이 위젯은 표준 및 유도 어세이 워크플로 모두에 적용됩니다.
ATP 생성률(유도) 위젯은 각 그룹에 대해 유도 glycoATP 생성률의 평균(상단 파란색 막대)과 유도 mitoATP 생성률의 평균(하단 빨간색 막대)으로 이루어진 누적 막대형 차트를 생성합니다(아래 그림, 오른쪽). 이 위젯은 유도 어세이 워크플로에만 적용됩니다.
- Add Widget(위젯 추가) > XF ATP Rate Assay(XF ATP 생성률 어세이) » Stacked bar chart(누적 막대 차트): 누적 막대 차트 위젯은 현재, XF ATP 생성률 어세이 위젯 목록에 있습니다. ATP 생성률(기초) 위젯은 각 그룹에 대한 기초 glycoATP 생성률(상단 파란색 막대)과 기초 mitoATP 생성률(하단 빨간색 막대)의 누적 막대 차트를 생성합니다(아래 그림, 왼쪽). 이 위젯은 표준 및 유도 어세이 워크플로 모두에 적용됩니다.
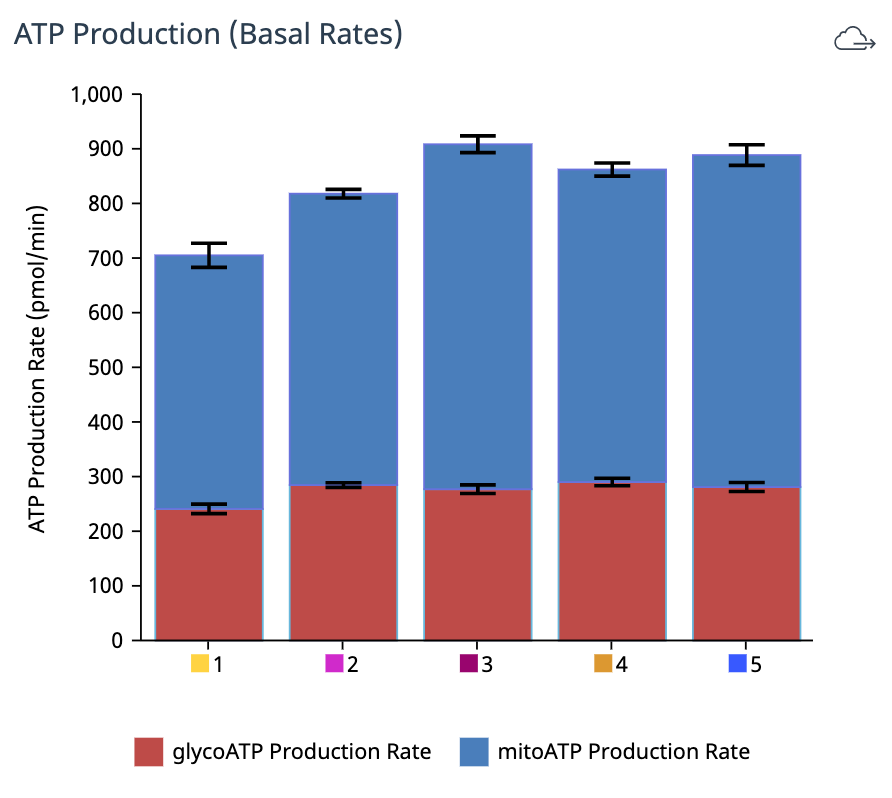
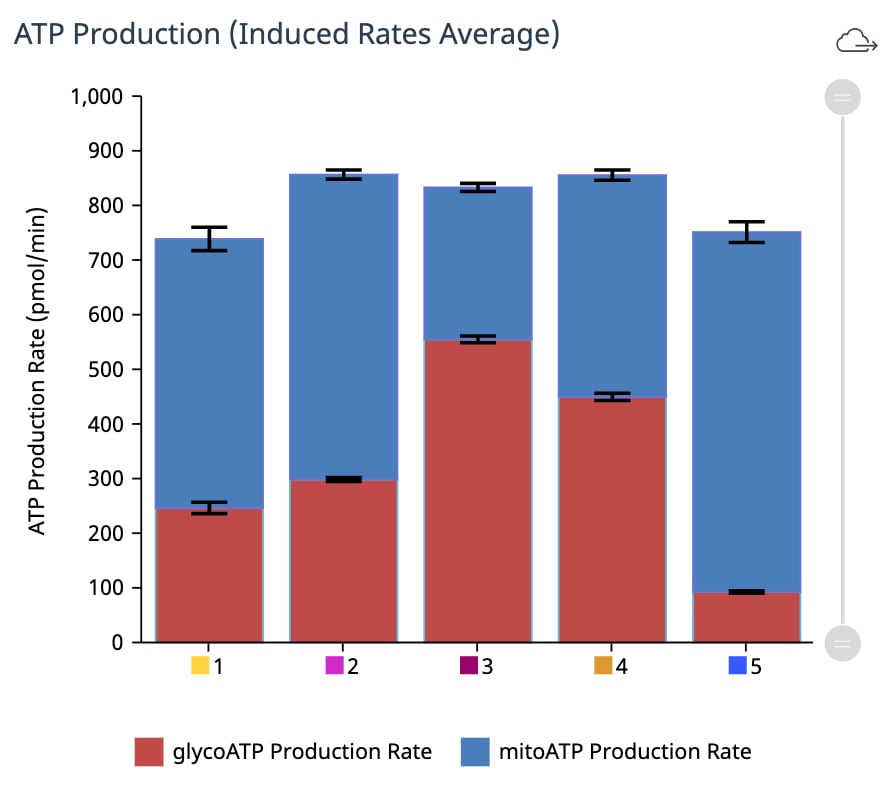
- Add Widget(위젯 추가) > XF ATP Rate Assay(XF ATP 생성률 어세이) » XF ATP Rate Index(XF ATP 생성률 지수): XF ATP 생성률 지수는 현재, XF ATP 생성률 어세이 위젯 목록에서 찾을 수 있습니다. XF ATP 생성률 지수 위젯은 기초 mitoATP 생성률 대 기초 glycoATP 생성률의 비율을 빈 원 마커로 표시하고, 각 그룹의 유도 mitoATP 생성률 평균과 유도 glycoATP 생성률 평균의 비율을 채워진 원 마커로 표시합니다(유도 어세이 결과 파일에 적용되는 경우에만 – 아래 그림의 위젯은 유도 XF ATP 생성률 어세이의 데이터를 보여줍니다). 또한 이 위젯 데이터를 계산하려면 먼저 buffer factor를 어세이 배지, 백그라운드 웰 및 어세이 그룹에 적합하게 할당해야 합니다.
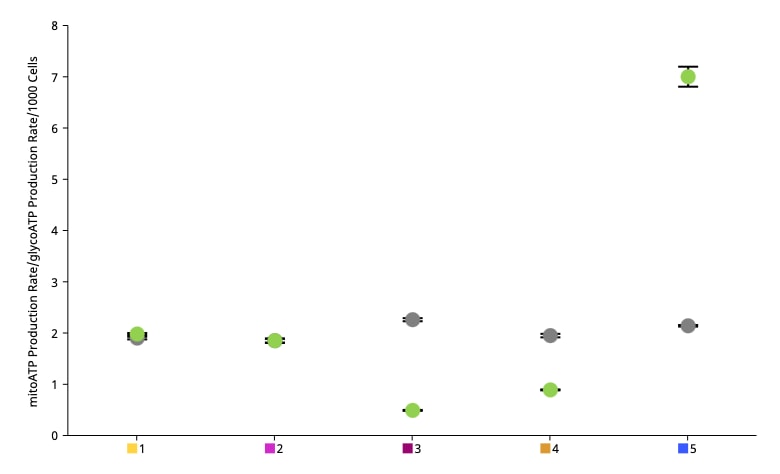
5.5 데이터 내보내기 및 공유
데이터를 Microsoft Excel 또는 GraphPad Prism 파일로 내보내거나 Seahorse Analytics를 사용하여 직접 공동 작업자와 결과 데이터 및 통찰력을 공유하세요.
데이터 내보내기:
Seahorse Analytics의 데이터를 Microsoft Excel, GraphPad Prism 또는 이미지 파일로 내보낼 수 있는 방법에는 여러 가지가 있습니다.
모든 속도 데이터 내보내기
선택한 파일에 대한 모든 속도 데이터가 포함된 Excel 및 Prism 파일을 생성할 수 있습니다. 이 내보내기에는 분석 보기에서 계산한 파라미터 계산(예: 예비 호흡 능력)이 포함되지 않으므로 각 위젯에서 해당 데이터를 개별적으로 내보내야 합니다.
모든 속도 데이터를 내보내는 방법:
- Files(파일) 또는 Home(홈) 보기로 이동합니다.
- 파일 열 오른쪽에 있는 점 3개 버튼을 클릭하여 메뉴를 표시합니다.
- Export to Excel(Excel로 내보내기) 또는 Export to Prism(Prism으로 내보내기)을 클릭하여 원하는 파일을 생성합니다.
- Home(홈) 및 Files(파일) 보기의 개별 파일 메뉴 아래에 있는 Export to Excel(Excel로 내보내기) 및 Export to Prism(Prism으로 내보내기) 옵션을 사용합니다(녹색 강조 표시, 오른쪽 그림).
이 내보내기 기능은 어떻게 사용되나요? 이러한 유형의 데이터 내보내기를 통해 사용자는 모든 속도 데이터(OCR, ECAR 및 PER)를 Prism 또는 Excel로 쉽게 전송하여 고품질 또는 맞춤형 수치를 생성하고, 통계 분석 및 Seahorse Analytics에서 제공되지 않는 기타 분석 기능을 수행할 수 있습니다.
개별 위젯에서 선택한 데이터 내보내기: 개별 위젯 데이터를 선택한 위젯에 대한 데이터가 포함된 Excel 및 Prism 파일로 내보낼 수 있습니다. 내보내기 파일의 데이터는 위젯 형식을 지정한 방식과 정확하게 일치합니다. 예를 들어 웰 모드에서 기초 호흡을 표시하도록 위젯을 구성하는 경우, Prism 내보내기 파일에는 각 그룹의 기초 호흡 데이터에 대한 개별 웰 값이 포함됩니다. 그룹 모드에서 기초 호흡을 표시하도록 위젯을 구성하면 Prism 내보내기 파일은 개별 웰 값이 아닌 평균 그룹 값과 오차 값을 표시합니다.
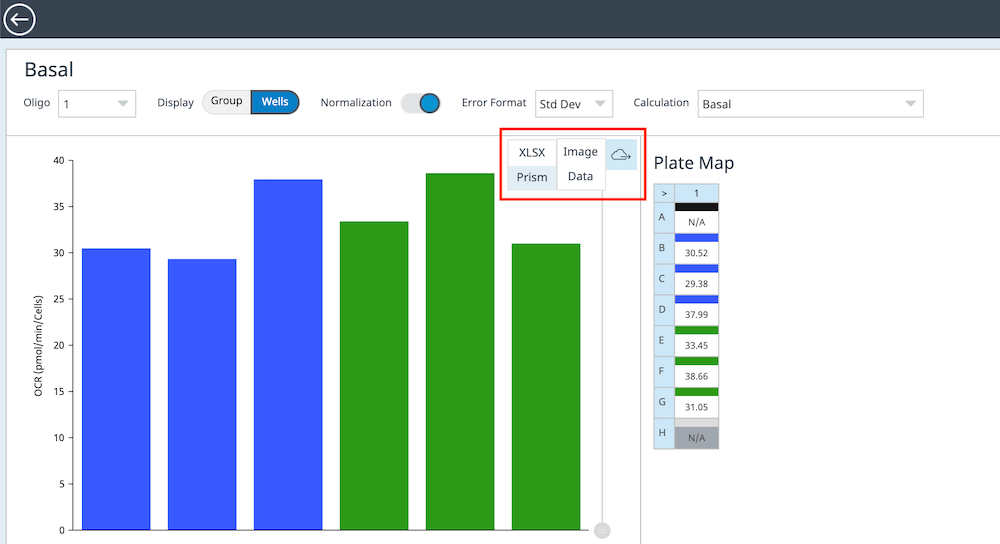
모든 속도 데이터를 내보내는 방법:
- 임의의 분석 보기 또는 위젯 편집기 보기에서 위젯 오른쪽 상단에 있는 작은 클라우드 버튼을 찾습니다.
- 클라우드 버튼 위로 마우스 커서를 이동하여 이미지 및 데이터 내보내기 옵션을 표시합니다.
- 커서를 이미지 위로 이동하여 위젯을 PNG 또는 JPG 파일로 내보내고, 데이터 위로 이동하여 위젯을 Excel 또는 Prism 파일로 내보냅니다.
- 내보내기 파일의 데이터는 위젯 형식을 지정한 방식과 정확하게 일치합니다. 이 예에서 Prism 내보내기 파일에는 플레이트의 두 그룹 모두에 대한 웰당 기초 호흡 값이 포함되어 있습니다.

이 내보내기 기능은 어떻게 사용되나요? 이러한 유형의 데이터 내보내기를 통해 사용자는 선택 속도 또는 파라미터 데이터를 이미지 파일이나 Prism 또는 Excel 파일로 쉽게 내보낼 수 있습니다. Prism 및 Excel 내보내기를 사용하면 모든 데이터를 내보내고 필요한 특정 정보를 찾는 대신 추가 분석하려는 데이터를 정확하게 얻을 수 있습니다(즉, 고품질 또는 사용자 정의 수치 생성, 통계 분석 및 Seahorse Analytics에서 제공되지 않는 기타 분석 기능 수행).
파일 공유:
내장된 파일 공유 기능을 사용하여 개별 어세이 결과 파일을 공동 작업자 또는 팀과 공유할 수 있습니다. 공유 기능은 홈 및 파일 보기(오른쪽 그림)의 각 어세이 결과 파일 오른쪽에 있는 작은 점 3개 메뉴 아래에 있습니다.
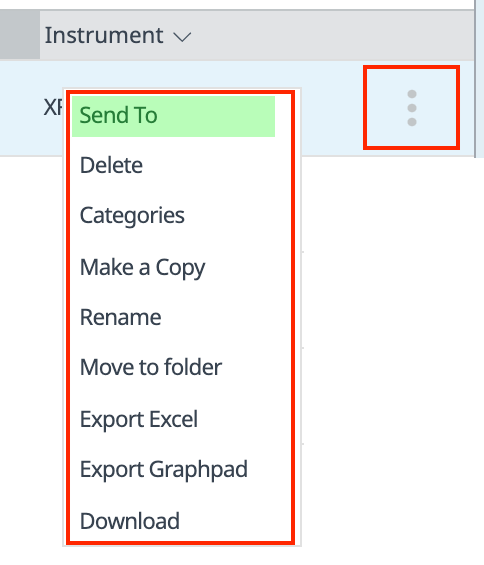
Send to(보내기 대상)를 클릭하여 대화상자를 표시하고 수신자의 이메일 주소를 입력한 다음, Send(보내기)를 클릭하여 데이터 파일을 보냅니다. 수신자에게 Seahorse Analytics 계정이 없는 경우, 데이터 파일을 보려면 계정을 만들어야 합니다. 수신자에게 계정이 있는 경우 파일이 공유되었음을 알리는 이메일을 받게 됩니다. 또한 Seahorse Analytics에서 공유 파일을 수락(또는 거부)하라는 알림을 볼 수 있습니다(오른쪽 상단의 종 모양 아이콘).
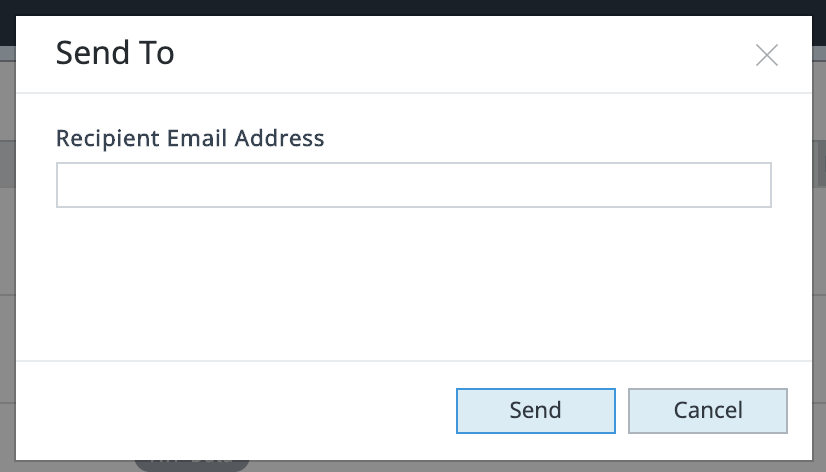
이 공유 기능은 어떻게 사용되나요? 공유 기능을 사용하면 Seahorse Analytics 계정이 있거나 없는 사람에게 응용을 통해 직접 어세이 결과 파일을 보낼 수 있습니다. 공유하기로 선택한 어세이 결과 파일은 수신자의 계정에 해당 데이터 파일의 복사본을 생성하며, 위젯 레이아웃, 선택 및 분석 보기는 파일 공유 전에 형식을 지정했던 것과 정확히 동일하게 나타납니다. 수신자는 공유 파일을 수정할 수 있지만 파일 사본은 변경되지 않습니다.

Seahorse에 대한 정보만 표시
기기 유형 변경이 섹션에서는 Wave Desktop 및 Report Generator 소프트웨어를 사용하여 어세이 결과 데이터를 보고 및 분석하는 내용을 알아봅니다. Seahorse Analytics에 대한 도움말 콘텐츠를 표시하려면 여기를 클릭하세요.
Wave Desktop은 XF, XFe 및 XFp 분석기에서 생성된 결과 파일에 대한 데이터 분석 소프트웨어입니다. Wave Desktop의 유연한 분석 보기, 내장된 보고 도구 및 기타 강력한 분석 기능을 사용하여 복잡한 세포 대사 데이터를 게시 가능한 결과로 변환하세요.
XF Report Generator는 각 Seahorse XF 어세이 키트의 파라미터를 자동으로 계산하고 결과 데이터를 한 페이지의 사용자 정의 가능한 요약 보고서에 표시하는 Microsoft Excel 매크로 파일입니다.
자세히 알아보려면 아래에서 주제를 선택하세요.
5.1 PC 사양 및 호환성
Wave Desktop은 모든 Seahorse 분석기를 위한 어세이 설계 및 데이터 분석 소프트웨어이며 다음과 같은 기능을 지원합니다.
- 모든 Seahorse 분석기(XFe96, XFe24, XFp, XF96 및 XF24)의 데이터 파일 분석.
- XFe96, XFe24 및 XFp 분석기용 어세이 템플릿을 생성하고 사용자 정의.
- (1) Microsoft Excel, (2) GraphPad Prism 또는 (3) XF Report Generator로 데이터 내보내기.
- Windows 및 Macintosh PC 모두에서 Microsoft Excel(32 및 64비트)을 지원.
항상 최신 버전의 Wave Desktop 소프트웨어로 업데이트하는 것이 좋습니다. Wave Desktop 소프트웨어의 최신 릴리스는 버전 2.6.1(2019년 4월)입니다. Wave Desktop 소프트웨어는 Windows 7 운영 체제 이상이 설치된 모든 PC에 설치할 수 있습니다.
아래에서 Wave Desktop 2.6 소프트웨어의 PC 사양 및 호환성 정보를 확인할 수 있습니다.
| 컴퓨터 | 사양 |
|---|---|
| Windows PC | 운영 체제: Windows 7, 8.1 및 10 |
| 프로세서: Intel Core i3(또는 그 이상) | |
| 하드 디스크 공간: 175GB | |
| 시스템 메모리(RAM): 4GB(최소*) | |
| 화면 해상도: 1280 x 800(최소) | |
| 지원되는 Excel 버전: 2010, 2013 및 2016 | |
| Macintosh PC(가상 컴퓨터 사용 필요) | 운영 체제: Mac OSx 10.11 이상 |
| 가상 컴퓨터: Parallels 12 및 Windows 7, 8.1 및 10 | |
| 프로세서: Intel Core i3(또는 그 이상) | |
| 하드 디스크 공간: 175GB | |
| 시스템 메모리(RAM): 4GB(최소*) | |
| 화면 해상도: 1280 x 800(최소) | |
| 지원되는 Excel 버전: 2011 및 2016 |
* 최적의 소프트웨어 경험을 위해서는 8GB(또는 그 이상) 시스템 메모리(RAM)가 권장됩니다.
관련 지원 자료
참고 자료
5.2 데이터 유형
세포의 산소 소비(호흡)와 양성자 배출(해당과정)은 용존 산소와 유리 양성자의 농도에 빠르고 쉽게 측정 가능한 변화를 일으킵니다. Agilent Seahorse XF 분석기는 마이크로플레이트 내의 세포 단층 위에 있는 매우 작은 부피(약 2μL)의 배지를 분리하여 용존 산소 및 자유 양성자의 농도를 실시간으로 측정한 후, 각각 OCR 및 ECAR을 계산합니다.
Wave Desktop 소프트웨어를 사용하면 다음 데이터에 쉽게 액세스 및 검토할 수 있습니다.
속도 데이터는 XF 분석기의 기본 출력 데이터입니다.
산소 소비율(OCR): 미토콘드리아 호흡의 지표인 웰 내 산소 소비의 정량적 측정은 피코몰/분(pmol/분) 대 시간 단위로 보고됩니다.
속도 모드에 표시된 산소 소비율(OCR) 데이터(오른쪽)
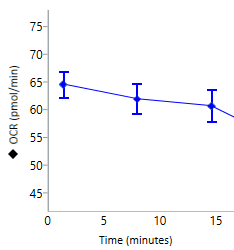
세포 외 산성화율(ECAR): 세포 외 배지에서 양성자 배출의 정성적 측정으로, milli-pH/분(mpH/분) 대 시간으로 보고됩니다.
속도 모드에 표시된 세포 외 산성화율(ECAR) 데이터(오른쪽)
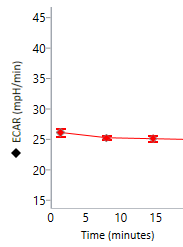
양성자 유출율(PER): 배지 완충 능력과 플레이트 구조를 설명하는 세포 외 산성화의 정량적 측정입니다. 피코몰/분(pmol/분) 대 시간으로 보고됩니다. 분석 실행 중에는 사용할 수 없고 실행 후 어세이 결과에서만 사용할 수 있습니다.
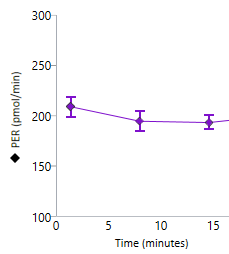
Wave 소프트웨어에서 사용할 수 있는 데이터 유형에 대한 자세한 내용은 Wave 사용자 가이드의 3장을 참조하세요.
레벨 데이터는 속도 데이터를 계산하는 데 사용되며 진단 목적으로도 사용될 수 있습니다.
산소 농도(mmHg): 측정 중에 세포(또는 기타 생물학적 물질)가 산소를 소비하므로 산소 분압이 감소합니다. 이러한 산소 분압의 감소는 산소 소비율(OCR)을 계산하는 데 사용됩니다. Y1 드롭다운 메뉴를 사용하여 개요 분석 보기에서 산소 분압 레벨 데이터를 볼 수 있습니다.
레벨 모드에서 mmHg 대 시간으로 표시되는 산소 분압(O2) 데이터(오른쪽)
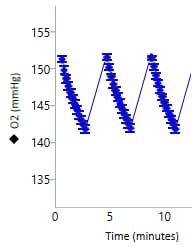
양성자 농도(mpH): 측정 중에 세포(또는 기타 생물학적 물질)가 양성자를 생성함에 따라 양성자 농도가 증가합니다. 마이크로챔버의 자유 양성자 농도는 XF 에세이를 통해 측정되며 세포 외 산성화율(ECAR)로 계산됩니다. Y1 드롭다운 메뉴를 사용하여 개요 분석 보기에서 mpH 레벨 데이터를 볼 수 있습니다.
레벨 모드에 표시된 양성자 농도(mpH) 데이터(오른쪽)
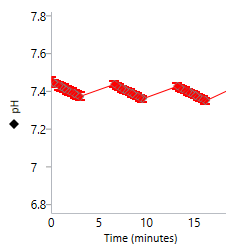
관련 지원 자료
참고 자료
5.3 데이터 표시 옵션
Wave는 어세이 결과 데이터를 보고 해석하기 위한 표준 그래프 옵션 세트를 제공합니다. 선택한 분석 보기 유형에 따라 Wave는 다음 중 하나로 결과 데이터를 자동으로 계산하고 그래프로 표시합니다.
키네틱 그래프
키네틱 그래프는 XF 분석기의 속도 데이터를 표시하는 가장 일반적인 방법입니다. 키네틱 그래프는 y축에 속도를 표시하고 x축에 시간을 표시합니다. 어세이 중에 데이터가 수집되어 키네틱 그래프로 실시간으로 표시됩니다. 키네틱 그래프는 Wave 소프트웨어의 빠른 보기 및 개요 분석 보기에서 볼 수 있습니다.
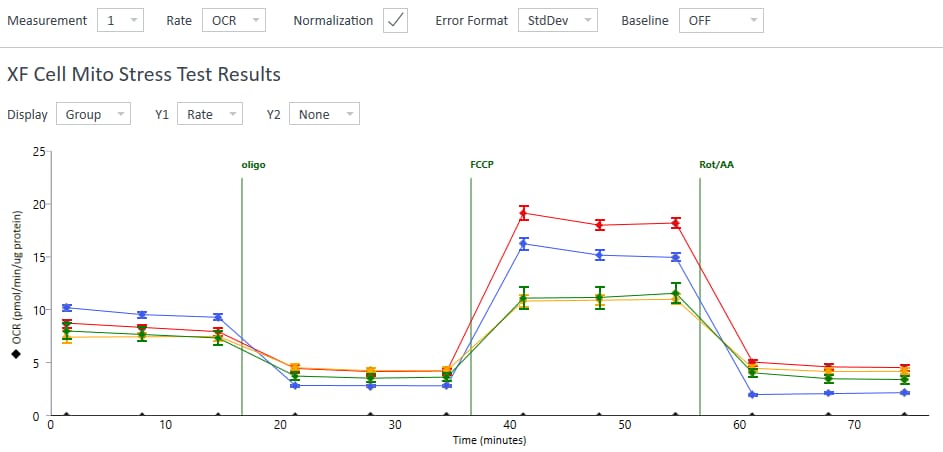
에너지 맵
XF 결과 데이터를 그래프로 표시하는 또 다른 일반적인 방법은 에너지 맵(산포도)으로, 산소 소비율(OCR)은 항상 y축에 표시되고 산성화 데이터(ECAR 또는 PER)는 항상 x축에 표시됩니다. 측정 드롭다운 메뉴를 사용하여 각 그룹의 에너지 맵에 표시할 속도 측정을 선택합니다. 속도 드롭다운 메뉴를 사용하여 x축 속도를 PER로 변경합니다. 에너지 맵 그래프 옵션은 빠른 보기 및 OCR 대 ECAR 분석 보기에서 볼 수 있습니다.
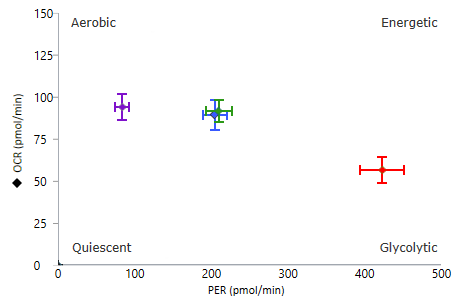
플레이트 맵
플레이트 맵은 각 어세이 웰의 선택된 속도 측정에 대한 속도 데이터를 표시합니다. 플레이트 맵은 어세이를 실행하는 동안 Wave의 오른쪽 상단 모서리와 빠른 보기, 개요 및 OCR 대 ECAR 분석 보기에 항상 표시됩니다. 빠른 보기에는 기본적으로 숨겨져 있는 플레이트 맵을 표시하는 버튼이 있습니다.
빠른 보기 및 OCR 대 ECAR 분석 보기의 플레이트 맵에는 산소 소비율(OCR - 상단)과 산성화 데이터(ECAR 또는 PER - 하단)의 두 가지 속도가 표시됩니다. 개요 분석 보기의 플레이트 맵에는 OCR, ECAR, PER 중 하나의 속도가 표시됩니다.
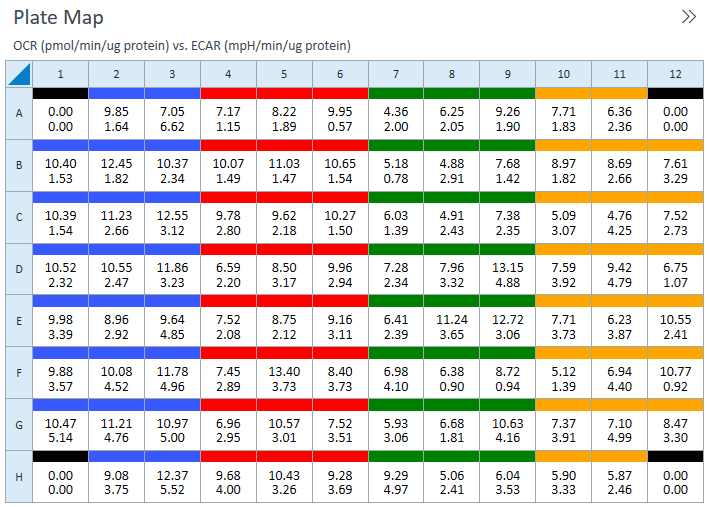
새로운 분석 보기를 열면 기본적으로 플레이트 맵에 속도 측정 1에 대한 데이터가 표시됩니다. 속도 드롭다운 메뉴를 사용하여 어세이 중에 다른 속도 측정에 대한 데이터를 표시합니다.
막대 그래프
막대 그래프는 개요 분석 보기(플레이트 맵 아래)에서만 사용할 수 있으며 선택한 측정에 대한 각 그룹의 평균 속도를 표시합니다. 디스플레이 드롭다운 메뉴를 사용하여 속도 표시를 그룹(평균)에서 웰(개별 웰) 모드로 변경합니다.
막대 그래프는 이상치, 최적 FCCP 농도, 최적 세포 분주 밀도, 또는 측정 데이터를 키네틱 그래프나 산포도로 플롯할 때 명확하지 않을 수 있는 기타 추세를 식별하는 데 사용할 수 있습니다.
그룹 목록
그룹 목록은 키네틱 그래프나 산포도에 플롯된 데이터에 대한 범례입니다.

그룹 목록을 사용하여 다음과 같은 기능을 수행합니다.
- 그룹 이름을 두 번 클릭하면 그래프 데이터에서 그룹을 숨기거나 표시할 수 있습니다.
- 그룹 통계를 표시하려면 그룹 목록 오른쪽 상단에 있는 Details(세부 정보) 상자를 선택합니다. 통계는 선택한 속도 측정에 대한 평균 및 오차로 표시됩니다. 해당 속도에 대한 그룹 통계를 표시하려면 다른 속도 측정을 선택합니다.
- 플레이트 맵에서 꺼진 어세이 웰은 계산된 그룹 통계에 포함되지 않습니다.
- 그룹이 숨겨지면 그룹의 평균 및 표준 편차는 다음과 같습니다. 평균: 0.00; 표준편차: 0:00.
Wave 소프트웨어에서 사용할 수 있는 데이터 유형에 대한 자세한 내용은 Wave 사용자 가이드의 3장을 참조하세요.
관련 지원 자료
참고 자료
5.4 분석 보기
Wave Desktop의 어세이 결과 파일에 추가할 수 있는 4개의 사용자 정의 가능한 분석 보기가 있습니다. 최상위 리본 메뉴의 Add View(보기 추가) 버튼을 사용하여 각 분석 보기를 어세이 결과 파일에 여러 번 추가할 수 있습니다.
빠른 보기
빠른 보기는 새로운 어세이 결과 파일을 열 때 표시되는 기본 분석 보기입니다. 빠른 보기는 OCR 대 시간, ECAR 대 시간, 및 OCR 대 ECAR의 에너지 맵의 키네틱 그래프를 동시에 표시합니다.
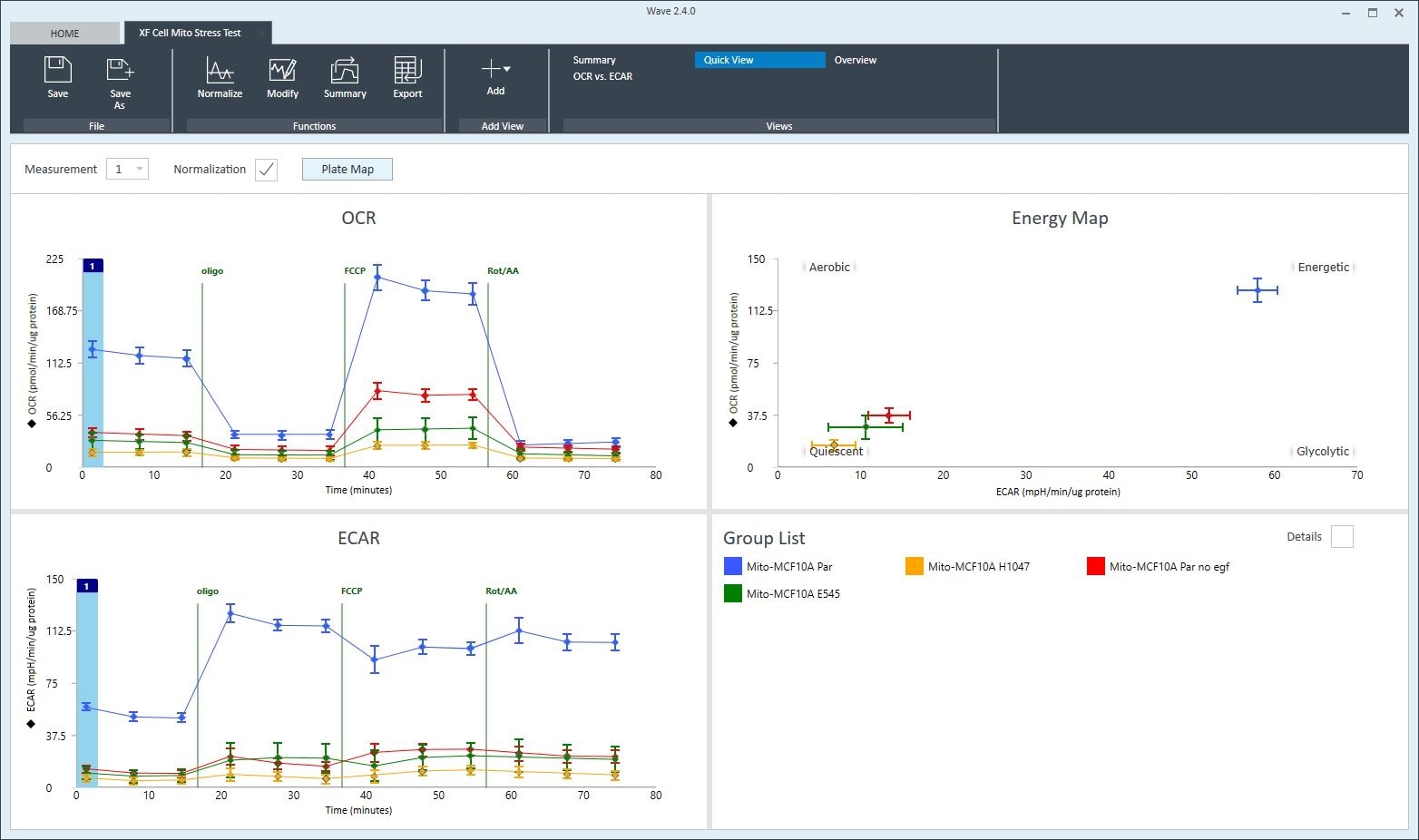
개요
개요에는 시간 대비 속도(OCR, ECAR, PER 또는 PPR)의 키네틱 그래프가 표시됩니다. y축에는 선택한 속도가 표시되고, x축에는 시간이 표시됩니다. 각 측정에 대한 그룹 통계(평균 속도 및 오차)는 키네틱 그래프 아래 그룹 목록의 Details(세부 정보) 상자를 선택하여 표시할 수 있습니다. 개요는 일상적인 분석 기능을 위한 Wave 소프트웨어의 가장 다양한 분석 보기입니다. 개요를 표시하려면 Add View(보기 추가)를 클릭하고 보기 목록에서 Overview(개요)를 선택합니다.
팁: 보기 추가 > 개요 프로세스를 반복하여 여러 개요 분석 보기를 추가합니다. 이를 통해 특정 그룹, 응답 또는 그룹 간 비교를 표시하도록 결과 데이터 표시를 유연하게 맞춤화할 수 있습니다.
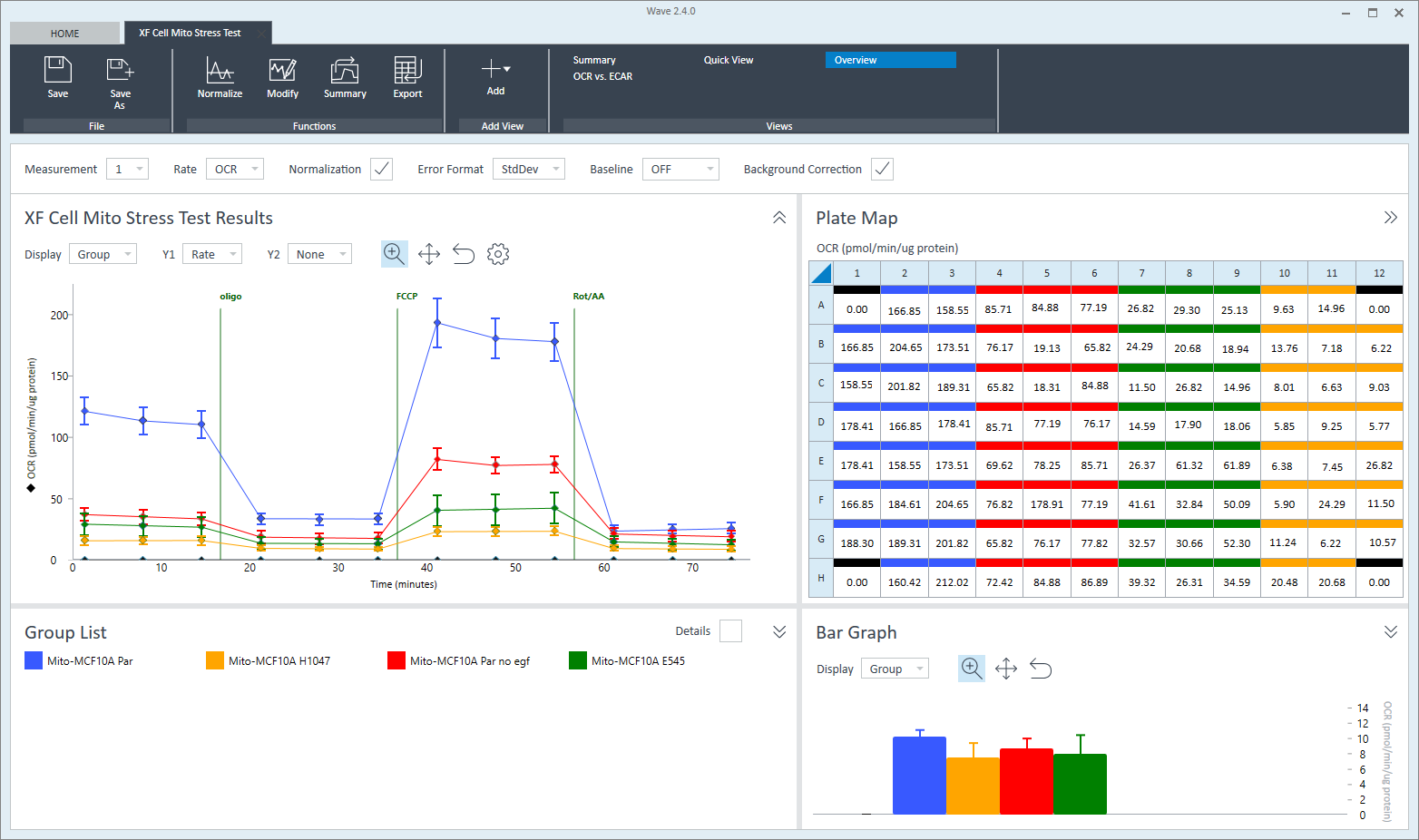
OCR 대 ECAR
OCR 대 ECAR 보기는 y축에 OCR이 있고 x축에 (기본적으로) ECAR가 있는 에너지 맵을 표시합니다. 속도 드롭다운 메뉴를 사용하여 x축에 표시되는 속도를 PER 또는 PPR로 변경합니다. OCR은 항상 y축에 표시되며 변경할 수 없습니다. OCR 대 ECAR을 표시하려면 Add View(보기 추가)를 클릭하고 보기 목록에서 OCR 대. ECAR을 선택합니다.
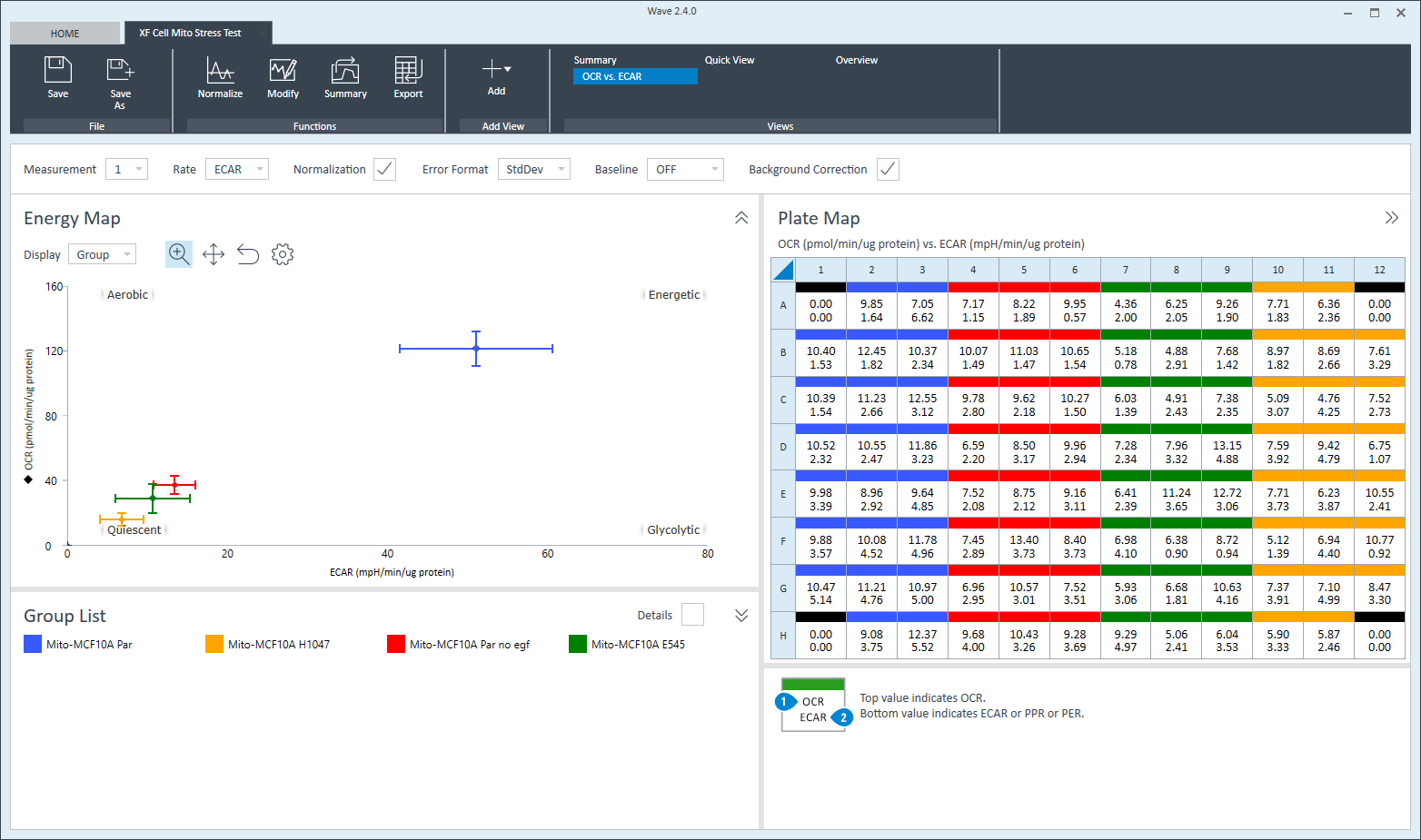
데이터
데이터 보기에는 어세이 결과 파일과 관련된 모든 데이터가 7개 탭으로 구성되어 있습니다.
- 그룹 데이터: 측정 번호별로 정렬된 각 그룹의 평균 속도 데이터(OCR, ECAR, PER 또는 PPR) 및 오차입니다.
- 속도: 측정 번호별로 정렬된 개별 웰 속도 데이터(OCR, ECAR, PER 또는 PPR)입니다. 오차 값은 표시되지 않습니다.
- 레벨 데이터: 측정 번호별로 정렬된 개별 웰 레벨 데이터(O2 및 pH)입니다.
- 원시: 각 측정에서 기록된 O2 및 pH 발광 값, 기준 값, 웰 및 환경 온도를 포함한 원시 측정 데이터입니다. 이 탭은 일상적인 데이터 분석이 아닌 기술 지원에 가장 일반적으로 사용됩니다.
- 보정: 웰별로 정리된 O2 및 pH 보정 결과입니다.
- 보정 보기: 각 어세이 웰에 대한 O2 및 pH 보정 결과로, 플레이트 맵으로 표시됩니다.
- 이벤트 로그: 분석기 일련 번호, 소프트웨어 버전, 플레이트 및 바코드 로트 번호, 어세이 중 기타 어세이와 같은 분석 정보입니다. 또한 명령 이름, 타이밍 및 결과를 포함하여 XF 분석 중에 사용되는 프로토콜 명령의 정렬 가능한 테이블도 제공됩니다.
데이터 보기를 표시하려면 Add View(보기 추가)를 클릭하고 보기 목록에서 데이터를 선택합니다. 데이터 보기를 열면 기본적으로 그룹 데이터 탭이 표시됩니다.
각 분석 보기에 대한 자세한 내용은 Wave 사용자 가이드의 3장을 참조하세요. 여기에는 베이스라인의 %로 데이터 재계산, 생물학적 파라미터(예: 세포 수)에 대한 속도 데이터 정규화, 플레이트 맵의 어세이 웰 플래그 지정 및 기타 주요 분석 기능과 특징을 포함합니다.
관련 지원 자료
참고 자료
5.5 XF Report Generator
Agilent Seahorse XF Report Generator는 각 Seahorse XF 어세이 키트의 파라미터를 자동으로 계산하고 결과 데이터를 한 페이지의 사용자 정의 가능한 요약 보고서에 표시하는 Microsoft Excel 매크로 파일입니다.
Wave는 한 번의 클릭으로 XF Report Generator로 결과 데이터를 직접 내보낼 수 있으며, 제외된 어세이 웰 또는 정규화된 속도 데이터와 같은 Wave의 결과 데이터에 대한 모든 수정 사항이 내보내고 분석된 보고서 생성기 Excel 파일에 통합됩니다. 사용 가능한 XF Report Generator 내보내기 옵션 목록을 표시하려면 최상위 리본 메뉴에서 Export(내보내기) 버튼을 클릭하세요.
XF Report Generator를 사용하는 이유는 무엇입니까?
- 보다 효율적이고 일관된 데이터 분석 - 원시 키네틱 데이터를 해석 가능한 결과로 변환하고 반복적인 수동 계산 및 데이터 축소와 같은 번거러운 작업을 제거합니다.
- XF 결과 데이터를 몇 초 만에 요약 - 데이터는 체계적이고 사용자 정의가 가능하며 이해하기 쉬운 보고서로 표시됩니다.
- 분석 요구에 맞게 확장 가능 - 다중 파일 XF Report Generator를 사용하여 한 번에 최대 5개의 반복 실험 결과 파일을 가져오고 분석합니다.
- 보다 간단한 협업 - 특별한 소프트웨어 프로그램이나 라이센스 없이 보고서 생성기에서 결과 데이터를 검토하고 재분석합니다.
- 다음과 같은 분석을 지원합니다.
- Seahorse XFe, XF 및 XFp 분석기에서 생성된 데이터 파일.
- Windows PC의 Microsoft Excel 2010, 2013 및 2016.
- Apple 컴퓨터의 Mac 2011 및 2016용 Excel.
| XF Report Generator - 다운로드 페이지 | 단일 파일 분석 | 다중 파일 분석 |
|---|---|---|
| Seahorse XF 세포 에너지 표현형 테스트 | 단일 파일 사용자 가이드 | 다중 파일 사용자 가이드 |
| Seahorse XF 세포 미토콘드리아 스트레스 측정 | 단일 파일 사용자 가이드 | 다중 파일 사용자 가이드 |
| Seahorse XF Real-Time ATP 생성률 어세이 | 단일 파일 사용자 가이드 | 제공되지 않음 |
| Seahorse XF 해당 속도 어세이 | 단일 파일 사용자 가이드 | 다중 파일 사용자 가이드 |
| Seahorse XF Mito Fuel Flex Test | 단일 파일 사용자 가이드 | 제공되지 않음 |
| Seahorse XF 해당작용 스트레스 측정 | 단일 파일 사용자 가이드 | 제공되지 않음 |
관련 지원 자료
참고 자료

Seahorse에 대한 정보만 표시
기기 유형 변경6. 고급 단계
XF 학습 센터의 이 섹션에서는 다양한 XF 어세이 키트 및 응용, 대체 어세이 조건 및 시료 유형, XF 데이터의 정규화 및 분석을 포함하여 XF 분석기 사용에 대한 다양한 주제를 소개합니다.
자세히 알아보려면 아래에서 주제를 선택하세요.
6.1 XF 분석 및 응용
Agilent XF 어세이 키트 및 시약은 결과의 신뢰성과 일관성을 보장하기 위해 각 XF 분석기와 함께 사용하도록 특별히 개발되었습니다. Seahorse XF 키트 및 시약은 살아있는 세포, 투과성 세포 및 분리된 미토콘드리아의 세포 ATP 생성 속도, 미토콘드리아 기능, 해당작용 활성 및 기질 산화를 비롯한 중요한 기능적 대사 파라미터를 측정하기 위해 사전 보정 및 테스트를 거친 시약을 제공하여 XF 어세이 실행을 단순화합니다.
참고: 모든 XFp 어세이 키트 및 소모품은 XF HS Mini 분석기와 호환됩니다.
아래 자료는 광범위한 XF 어세이를 수행하기 위한 정보와 분석법을 제공합니다.
세포 ATP 생성
미토콘드리아 기능
미토콘드리아 기질 산화
- 개요: XF Substrate Oxidation Stress Test
- 키트 정보: Seahorse XF Substrate Oxidation Stress Test Kit
- 키트 정보: Seahorse XF Palmitate Oxidation Stress Test Kit 및 FAO 기질
- 응용 자료: Agilent Seahorse XF Substrate Oxidation Stress Test를 사용해 세포 대사 표현형 및 기능 확인
- 웨비나: Agilent Seahorse XF Substrate Oxidation Stress Test를 이용하여 세포 대사 표현형 및 기능 분석
면역 세포 활성화 어세이
6.2 XF 대사 데이터 정규화를 위한 분석법 및 전략
다양한 세포 유형, 유전자 변형 또는 화합물 처리의 비교 여부에 관계없이 기능적 생물학적 데이터의 정규화는 XF 어세이 및/또는 XF 데이터의 후속 분석 및 해석을 수행하기 위한 워크플로에서 핵심적 요소입니다. XF 어세이의 정규화는 세포 수, 게놈 DNA 및 총 세포 단백질을 포함한 여러 레벨에 적용될 수 있습니다.
아래 자료는 XF 데이터 정규화 분석법에 대한 정보를 제공합니다.
6.2 지방산 산화 어세이
대사 경로 및 에너지 소비의 조절, 그리고 차등적 기질 산화가 대사적으로 조절되는 신호 전달 메커니즘에 대한 기여 방식은 면역학, 암 및 줄기 세포 생물학, 약물 표적 식별 및 작용 메커니즘 연구와 같은 다양한 분야의 연구자에게 중요한 주제입니다.
6.3 투과성 세포와 분리된 미토콘드리아
미토콘드리아 기능에 대한 연구는 임상 및 기초 과학 연구의 핵심입니다. Agilent Seahorse XF 세포 미토콘드리아 스트레스 측정은 초기 미토콘드리아 생체에너지 프로파일을 제공합니다. 그러나 관찰된 변화를 유도하는 정확한 효소 또는 경로를 조사하면 질병 상태에 따른 대사 효소의 추가적인 통찰력과 추가 연계별 변경을 제공할 수 있습니다.
기질 산화를 연구하는 전통적인 분석법에는 미토콘드리아 분리가 포함되며, XF 분석기는 최소한의 분리된 미토콘드리아를 사용한 기전 연구를 위해 에너지 수요와 기질 가용성을 모두 엄격하게 제어할 수 있는 고처리량 어세이를 지원합니다.
그러나 제한된 양, 그리고 분리 중 미토콘드리아의 하위 선택 또는 손상으로 인한 편향을 포함해 미토콘드리아를 분리할 때 몇 가지 단점이 존재합니다. XF Plasma Membrane Permeabilizer (PMP)는 미토콘드리아 막에 수반되는 손상을 일으키지 않고 부착 세포의 원형질막에 공극을 형성합니다. 이 시약은 분리된 미토콘드리아 또는 손상되지 않은 세포가 있는 기질 보충 배지를 사용할 때 따르는 문제를 해결해 줍니다.
투과성 세포
- 개요: XF Plasma Membrane Permeabilizer 시약
- 기술 자료: XF PMP(Plasma Membrane Permeabilizer)로 투과화된 세포를 사용하여 미토콘드리아 호흡 복합체 평가
- 기술 자료: PMP를 사용하여 투과성 세포에서 기질 특이적 ETC/OxPhos 활성화 측정
- 기술 자료: PMP를 사용하여 제한된 생체 재료에서 미토콘드리아 ETC 복합체 활성화 측정
- 발행물: Seahorse XF 분석기 또는 Clark형 산소 전극을 사용하여 투과성 세포에서 미토콘드리아 기능 측정(Divakaruni, et al, Curr Protoc Toxicol, 2014)
- 발행물: Thiazolidinedione, 미토콘드리아 피루브산 운반체의 급성 특이적 억제제(Divakaruni, et al, PNAS, 2013)
분리된 미토콘드리아
- 응용 자료: Agilent Seahorse XFe/XF96 분석기로 분리된 미토콘드리아의 마이크로그램 양 분석
- 응용 자료: Agilent Seahorse XFe/XF24 분석기로 분리된 미토콘드리아의 마이크로그램 양 분석
- 발행물: 최소량의 분리된 미토콘드리아를 사용한 고처리량 마이크로플레이트 호흡 측정(Rogers, et al, PLoS One, 2011)
- 발행물: 피부경유바늘생검으로 얻은 골격근 조직에서 분리된 미토콘드리아의 전처리 및 호흡 능력 평가(Bharadwaj et al, JOVE, 2015)
- 발행물: 고처리량 마이크로플레이트 호흡 측정을 위해 최소량의 마우스 골격근에서 미토콘드리아 분리(Boutagyet al, JOVE, 2015)
- 발행물: 고처리량의 마이크로플레이트 호흡 측정을 위해 최소량의 마우스 골격근에서 분리된 미토콘드리아 사용(Boutagy, et al, JOVE, 2015)
6.4 저산소 및 Spheroid
6.4 저산소 및 섬세포
6.4 저산소 조건
분석기는 산소가 감소된 환경(저산소 조건)뿐만 아니라 섬세포를 포함한 특정 유형의 3차원 시료에서 대사를 측정하는 기능을 갖추고 있습니다. 분석기는 Spheroid를 포함한 특정 유형의 3차원 시료뿐만 아니라 산소가 감소된 환경(저산소 조건)에서 대사를 측정하는 기능을 갖추고 있습니다. 분석기는 산소가 부족한 환경(저산소 조건)에서 대사를 측정하는 기능을 갖추고 있습니다.
저산소 조건
Spheroid

Seahorse에 대한 정보만 표시
기기 유형 변경추가 정보가 필요하세요?
온라인 스토어에서 XF 어세이에 필요한 카트리지, 플레이트, 키트, 배지 및 시약을 구매하세요. XF 분석기를 위한 모든 Seahorse 세포 분석 소모품 전체 목록을 찾아보세요.
온라인 스토어
온라인 스토어에서 XF 어세이에 필요한 카트리지, 플레이트, 키트, 배지 및 시약을 구매하세요. XF 분석기를 위한 모든 Seahorse 세포 분석 소모품 전체 목록을 찾아보세요.
XF 어세이 구매상담하기
Agilent Seahorse XF 담당자에게 연락하여 데모 일정을 잡고 Agilent Seahorse XF 분석기가 어떻게 귀하의 연구에 필요한 부분을 해결할 수 있는지를 알아보세요.
데모 요청하기전세계 기술 지원
글로벌/미국:
+1 719 528 7500
미국(무료 전화):
+1 800 227 9770
유럽 무료 전화:
00 800 345 347 00
(영국, 아일랜드, 프랑스, 독일, 덴마크 또는 네덜란드)
기타 국가: +45 8830 5500
중국(수신자 부담 유선 전화):
800 820 3278
중국(수신자 부담 휴대전화):
400 820 3278
