
M. Darwin, Bricoleur
한때는 파리의 최소한 사람들이 정말로 거주했던 지구 내 어디에서나 ‘브리콜뢰르’라는 간판이 붙어있는 작고 특색 없는 가게들을 찾아볼 수 있었습니다. 가게 안에는 먼지 쌓인 온갖 물건들이 가득했습니다. 잡다한 물건들이었으나 그래도 누군가에게는 쓸모 있었을 겁니다. 아마도요.
분자생물학의 아버지이자 2차 대전 당시 프랑스 레지스탕스의 영웅이었던 위인, 그리고 오랜 세월 파리지앵으로 살아온 François Jacob은 브리콜라주(Bricolage)를 수선하는 것이라 번역하며 이렇게 이야기했습니다. “수선공은 창고에 굴러다니는 물건을 하나 집어 예상치 못했던 기능을 부여하는 사람이다. 낡은 차 바퀴를 선풍기로 만들거나 부서진 탁자를 파라솔로 변신시키는 식이다”. Jacob은 단순히 감성에 젖어 옛날을 회고하는 것이 아니었습니다. 그것은 진화와 그 예측할 수 없는 특성의 핵심을 꿰뚫는 말이었습니다. “이러한 과정은 다리가 날개로 변화하거나 턱의 일부가 귀의 한 부분으로 탈바꿈하는 진화의 양태와 크게 다를 것이 없다”.
의인화를 빌어 설명한다면, 진화는 설계가 불가능합니다. 유기체의 게놈 안에 이미 존재하는 유전자를 무작위로 돌연변이시켜 좀 "수선하는” 것입니다. “설계나 제작과는 반대로 진화는 혁신을 백지에서부터 그려내지 않는다. 자연 선택은 인간 행동의 어떤 측면과도 유사하지 않다. 그럼에도 굳이 비교해 설명하자면 이 과정은 설계나 제작이라기보다는 수선, 프랑스어로 브리콜라주(Bricolage)라 부르는 공정에 가까울 것이다… 폐를 식도의 일부로 바꿔놓는 것은 할머니의 커튼을 치마로 만드는 것과 아주 흡사하게 들린다."1

유전적 변화, 눈에 띄지도 않을 만큼 작은 일부가 무계획적으로 축적되었을 때 어떤 목적을 띤 궤적으로 나타나는 것은 확실히 할머니의 커튼이 치마로 변하는 것과 비슷하게 보입니다.
게다가 꼭 브리콜라주와 같이, 일이 잘못 돌아가는 경우 정말 심각하게 잘못될 수도 있습니다.
암과 유전자?
암에서의 유전적 관여에 대한 우리의 이해의 발달은 유전학과 분자생물학 자체에 대한 우리의 이해의 발달과 그 궤를 같이합니다. 19세기 후반 중기 염색체와 유전 사이의 연결고리가 만들어졌을 때, 빠르게 분열되는 암세포 내의 응축된 중기 염색체 실험으로 염색체 구조 이상이 밝혀졌습니다. 그 후 머지않아 Theodor Boveri2가 후천적인 염색체 이상이 세포가 통제할 수 없게 분열되도록 촉발해 암을 유발할 수 있다는 이론을 제시했습니다. 이것이 어떻게 발생하는지는 아직 밝혀지지 않았습니다.
암은 감염된다?
암이 때때로 개 한 마리에서 다른 개로 옮겨갈 수 있다는 Novinsky의 실증은 사실 염색체에 관한 연구보다 앞서 진행되었습니다. 옮겨 다니는 암이란 꼭 감염병처럼 들립니다. 그리고 1911년, Peyton Rous3가 "세포를 제거하고 남은 소량의 물질"이 한 닭에서 다른 닭으로 육종을 옮긴다는 것을 증명해 냈습니다. 무세포 감염인자인 액성전염물질(Contagium Vivum Fluidum)은 1898년에는 처음 바이러스라 불렸으나,4 1935년 전자현미경 검사에서 바이러스는 단립자라는 사실이 밝혀진 이후에는 그렇게 불리지 않았습니다. 그렇다면 암은 정말 감염병이었을까요?
Boveri와 Rous가 서로 충돌하는 이론을 내놓자마자 Phoebus Levene은 생물학 역사에서 가장 대단한 관심을 끌었던, 그 악명 높은 테트라뉴클레오티드 가설(Tetranucleotide Hypothesis)을 상정했습니다. 이로 인해 핵산과 같이 단순한 분자는 모두 유전적 정보를 전달할 수 없다는 것이 “확실”해 보였습니다. 염색체와 관련된 것으로 보이는 핵산은 분명히 어떠한 종류의 구조적 요소였으나, 당시 아직 밝혀지지 않은 단백질이 유전자의 물리적 기초였습니다.5 하지만 이 모든 것이 암과 어떤 관련이 있는 걸까요?
올바른 토대 세우기(나름대로)
분자 유전학이 명료해지기 시작하며, 좀 더 친숙해지게 된 것은 1940년대 후반 이후였습니다. Avery와 Macleod와 McCarty 그룹, 그리고 Hershey와 Chase 그룹은 핵산이 유전 정보를 전달한다는 것을 명확하게 입증해 냈습니다. Erwin Chargaff는 다른 유기체에서의 DNA 염기 조성을 정량 분석을 통해 샤가프의 법칙을 입증해 냈습니다. 이로써 테트라뉴클레오티드 가설이 잘못되었음을 밝혀냈을 뿐 아니라 왓슨과 크릭이 이중나선을 위해 그렸던 모델의 핵심적인 통찰력까지도 제공했습니다. 따라서, DNA가 단백질을 만드는 RNA를 만들어냅니다. 이후 역전사효소의 발견으로 우리는 RNA가 단백질을 만드는 RNA를 만드는 DNA를 만든다는 사실을 알아냈습니다. 그런데 이 모든 것이 암과 무슨 연관이 있는 걸까요?

라우스육종바이러스(RSV)는 다른 많은 바이러스와 마찬가지로 상대적으로 단순합니다. 딱 네 개의 유전자로 이루어져 있습니다. Vogt의 연구실에서 진행된 돌연변이 연구5에서는 RSV의 네 가지 유전자 중 하나인, src 또는 sarc라고 불리는 유전자라는 것을 밝혀냈습니다. 종양을 유발하는 바이러스의 특성에 영향을 미치는 것입니다. 돌연변이 src와 바이러스는 여전히 감염의 특성을 보였으나 더는 암을 일으키지는 않았습니다. 그러니까 src 유전자는 암을 “유발”하는 세포 유전자에 결합합니다. 그들은 src를 종양유전자, 즉 종양을 유발하는 유전자라 불렀습니다.
모두들 그랬지만 Peyton Rous는 암이 유전적 소인이라는 것을 믿지 않았습니다. 1966년, RSV를 발견한 뒤 50년 이상이 지나서야 노벨상을 받은 Rous는(돌연변이적 분석으로 재점화된 관심 덕에), 암의 유전적 기초를 받아들일 수 없었습니다. 노벨상 수상 연설에서 그는 딱 잘라 말했습니다.
"그간 가장 힘을 얻어온 가설은 종양유발원(Oncogen)*이 체내 세포 유전자의 변형을 초래한다는 내용으로, 체세포 돌연변이(Somatic mutation)라는 용어로 일컬어집니다. 하지만 수많은 사실을 한데 모아보면 이 가설은 결단코 받아들여질 수 없습니다."6
*종양유전자(Oncogene)와 혼동하지 말 것. Rous는 암을 유발하는 화학적 요인을 언급할 때 기존에 통용되던 발암 물질(Carcinogen)이라는 용어 대신 종양유발원(Oncogen, 뒤에 e가 붙지 않음)이라는 단어를 사용하기를 주장했습니다
"아하!"를 외친 순간
그러던 어느 날, 모든 조각을 하나로 맞춰주는 도약의 순간이 다가왔습니다. UCSF의 J. Michael Bishop과 Hal Varmus 그룹은 조류의 게놈에 이미 src 유전자의 유사체가 존재했다는 것을 증명했으며7, 더 넓게는 모든 동물의 게놈에서도 나타나는 것으로 보였습니다. 원발암유전자, 즉 프로토 온코진(Proto-oncogene)은 세포 속 시한폭탄이나 마찬가지입니다. 돌연변이 유발물질, UV 조사 또는 불운하게 발생한 복제 오류 등으로 이 유전자에 돌연변이가 일어나면 암을 일으킵니다. 마침내 분자 단위의 설명이 모습을 드러냈습니다. Varmus와 Bishop 이후에도 40여 개의 원발암유전자(Proto-oncogene)가 발견되었습니다. 세포핵 안에서 시한폭탄처럼 째깍거리고 있는 40여 개의 잠재적 재앙이었던 셈입니다.
유전학자가 가장 좋아하는 숫자
1960년대 후반 Henry Harris가 진행한 세포 융합 실험에서는 정상 세포를 암세포와 융합하면 암세포의 종양 형성을 억제할 수 있다는 것을 밝혀냈습니다. 그 후 Alfred Knudson이 기념비와도 같은 망막아종(Retinoblastoma) 연구에서 망막아종 가족력이 있는 아동과 없는 아동의 망막아종 발생률을 대조 활용하여 “투 히트(Two-hit)” 가설을 발전시켰습니다. 예를 들면 망막아종을 유발하기 위해서는 두 가지 돌연변이가 발생해야 한다는 것입니다. 유전자의 정상 복제와 이미 돌연변이된 복제를 가진 이형접합 아동에게는 망막아종이 유발되기까지 한 번의 추가 돌연변이가 필요했습니다. 반대로 두 개의 정상 유전자를 가진 동형접합 아동에게는 두 개의 돌연변이가 일어나야 했고, 자연 발생 체세포 돌연변이의 일정한 진행 시간때문에 더 오랜 시간이 걸렸습니다. Knudson의 1971년 논문8 속 그림 1은 생물학 역사상 가장 중대하고 아름다운 하나임에 틀림 없으며, 예측된 행동을 분명하게 보여줍니다. 유전자의 두 복제는 암을 유발하기 위해서는 돌연변이에 의해(오늘날이었다면 이렇게 말했을 것입니다) “나가 떨어져”야만 했습니다. 꼭 멘델의 유전법칙에서 돌연변이 유전자가 열성(기능 상실)일 경우에 예측된 것과 같이 말입니다.
"정답"은 회문 구조(Palindrome)
종양유전자와 종양억제유전자는 거의 거울상에 가깝습니다. 원발암유전자와와 종양억제단백질은 모두 정상 세포 성장의 조절에 관여합니다. 원발암유전자 내 돌연변이는 기능적으로 Knock in되는데, 이로 인해 통제할 수 없는 세포 성장이 일어나는 반면, 종양억제유전자 내 돌연변이는 세포 성장을 조절하는 능력이 Knocks out되게 됩니다. 양쪽 모두 동일한 암 유발 결과로 이어집니다.
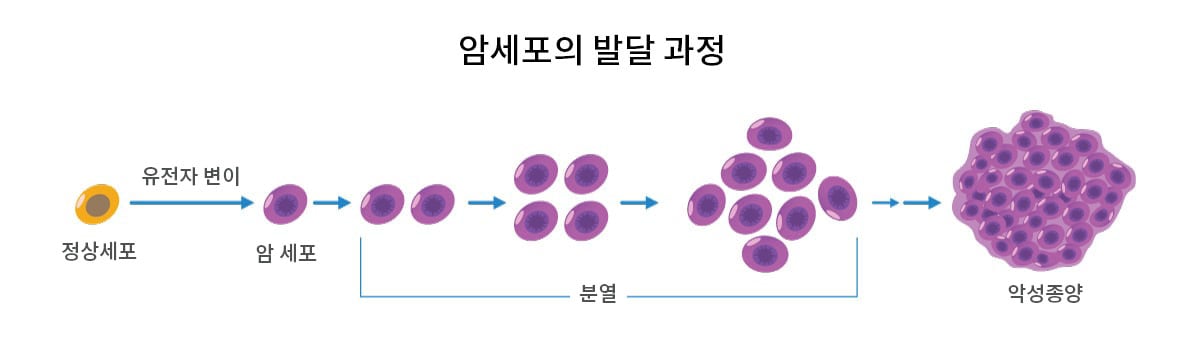
암: 브리콜라주가 잘못되면
예측 가능한 사건에 대실패의 가능성이 들어가 있다니, 그 어떤 제작자가 이런 식으로 시스템을 설계할까요? 이제 우리는 인산화효소의 원발암유전자와 종양억제유전자 코드, 전사 인자, 또는 세포 조절에 관여하는 다른 핵심 단백질 등을 압니다. 그 안에서의 돌연변이는 미세하게 맞춰진 세포 조절 네트워크의 조절 장애를 유발합니다. 우리는 이렇게 돌연변이된 단백질들이 유발하는 세포 조절 장애를 점점 더 많이 밝혀 나가고 있습니다. 예를 들면 신호 증폭 단계를 바꿔놓는 단백질 인산화의 변화, 달라진 물질대사 그리고 대사물 농도 변화를 유발하는 세포 내 수송 문제 등이 있습니다. 이렇게 마침내 종양유전자와 종양억제돌연변이, 특히 드라이버 돌연변이(driver mutation)를 연관지을 수 있게 되고, 세포 생리 내 변화 및 세포 외 종양 미세환경을 바꿀 수 있게 되면서 종양 세포 생리의 종합적인 그림을 그릴 수 있게 되었습니다.
물론 형질전환과 종양세포화에는 복수의 돌연변이가 필요하므로 단일 돌연변이만으로 세포의 형질이 전환된다고 보기에는 어렵습니다. 실제로 종양 세포에 얼마나 많은 체세포 돌연변이가 있는지를 보여주는 종양변이부담(Tumor Mutational Burden, TMB)이 치료 효과를 예측해주는 오늘날 중요 바이오마커입니다.

최근 일부 연구자들은 돌연변이된 종양유전자 또는 신생항원이라 불리는 종양억제자에서 HLA 펩타이드를 표적화하여 암세포를 표적화하려는 시도를 해왔습니다. Science9지 및 Science Immunology10지 내 Johns Hopkins의 최근 논문 두 편에서는 T 세포 관여 이중 항체(Bi-specific Antibody)가 HLA 제시 펩타이드에 결합할 수 있으며, 이는 돌연변이된 종양유전자, 또는 종양억제단백질 및 일부 케이스에서는 in vivo 활동을 보였다는 것을 입증했습니다.
그러니 분명히 암에 관해서는, 브리콜라주는 둘의 게임입니다.